
题目列表(包括答案和解析)
1.试验室中,要使AlCl3溶液中的全部沉淀出来,最适宜选用的试剂是 ( )
A. Ba(OH)2溶液 B . NaOH溶液 C. 盐酸 D. 氨水
14.已知室温下BaSO4在纯水中的溶解度为1.07×10-5mol·L-1,BaSO4在0.010mol·L-1
Na2SO4溶液中的溶解度是在纯水中溶解度的多少倍?(已知KSP (BaSO4)=1.07×10-10 )
13.将等体积的4×10-3mo1·L-1的AgNO3和4×10-3mo1·L –1 K2CrO4混合,有无Ag2CrO4沉淀产生? (已知KSP (Ag2CrO4)=1.12×10-12 )。
12.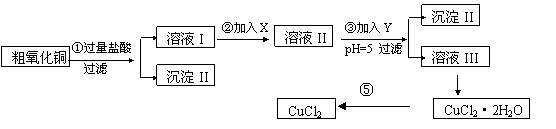 某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取无水氯化铜,其制备步骤如下:
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取无水氯化铜,其制备步骤如下:
实验过程中所用的物质x,y及pH控制参照下表确定:表I
|
物质 |
开始沉淀时pH |
完全沉淀时pH |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Cu(OH)2 |
5.2 |
6.4 |
表Ⅱ
|
氧化剂 |
调节pH的物质 |
||
|
A |
双氧水 |
E |
氨水 |
|
B |
高锰酸钾 |
F |
碱式碳酸铜 |
|
C |
氯水 |
G |
氧化铜 |
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是 。
(2)步骤②加入的试剂x可选用表Ⅱ中的(填序号,且选出全部合理的),其作用是 .
(3)步骤③加入的试剂y可选用表Ⅱ中的 (填序号,且选出全部合理的),控制pH=5的目的是 。
(4)步骤⑤要得到无水CuCl2,应控制的一定条件是 。
(5)步骤①中所发生的全部反应的离子方程式: 。
11.水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水的电离平衡的离子
浓度,当温度升高到100℃时,水的电离平衡状
态移动到B点,则此时水的离子积
从________变化到_________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混
合,并保持100℃的恒温,致使混合溶液
的pH=7,则Ba(OH)2和盐酸的体积比为__________________。
(3)已知AnBm的离子积为[c(Am+)]n[c(Bn-)]m,若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,其离子积约为______________。
10.将足量BaCO3分别加入:① 30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为 ( )
A.①②③④ B..③④①② C.④③①② D.②①④③
9.已知K2HPO4溶液中,HPO42―的水解程度大于电离程度,对于平衡:
HPO42-+H2O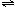 H+ + PO43-,欲使溶液中c(HPO42-)、c(H+)、c(PO43-) 三种离子溶度均减小,可采用的方法是 ( )
H+ + PO43-,欲使溶液中c(HPO42-)、c(H+)、c(PO43-) 三种离子溶度均减小,可采用的方法是 ( )
A. 加水 B. 加热 C. 加消石灰 D. 加硝酸银
8.石灰乳中存在下列平衡:Ca(OH)2(s)
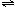 Ca2+(aq)+2OH― (aq),加入下列溶液,可使Ca(OH)2减少的是 ( )
Ca2+(aq)+2OH― (aq),加入下列溶液,可使Ca(OH)2减少的是 ( )
A. Na2CO3溶液 B. AlCl3溶液 C. NaOH溶液 D. CaCl2溶液
7.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝矿,如Al2O3中。用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为 ( )
A.镓酸酸性强于铝酸 B.铝酸酸性强于镓酸
C.镓浓度小,所以不沉淀 D.Al(OH)3是难溶物
6.在100ml0.01mol/LKCl溶液中,加入1ml0.01mol/LAgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10) ( )
A.有AgCl沉淀析出 B.无AgCl沉淀
C.有沉淀,但不是AgCl D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com