
题目列表(包括答案和解析)
5、下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A.100 ml 0.5 mol/L MgCl2 溶液 B.200 ml 0.25 mol/L HCl溶液
C.50 ml 1 mol/L NaCl溶液 D.200 ml 0.25 mol/L CaCl2溶液

4、设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
A.1 mol NH3所含有的原子数为NA B.常温常压下,22 .4 L氧气所含原子数为2NA
C.常温常压下,48 g O3所含氧原子数为3NA D.1 L 0.1 mol/L NaCl溶液中所含Na+为NA
3、关于2 mol二氧化碳的叙述中,正确的是( )
A.摩尔质量为88g/ mol B.质量为88g C.分子数约为6.02×1023 D.有4mol原子
2、乐山地区的自来水是采用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的( )
A.石蕊溶液 B.四氯化碳 C.氢氧化钠溶液 D.硝酸银溶液
1、如果在厨房不小心将花生油与凉开水混在一起,你将采用何种方法进行分离( )
A.过滤 B.蒸馏 C.分液 D.萃取
12. (每小题6分共12分)将密度为1.84g/cm3、质量分数为98%的浓硫酸稀释成1000ml、物质的量浓度为2mol/L、密度为1.20g/cm3的稀硫酸。求:
⑴所需浓硫酸的体积(保留一位小数);⑵所需水的体积
11.实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:
⑴实验中除了托盘天平、烧杯、容量瓶外还需要的其它仪器有:(6分)
⑵根据计算得知,所需NaOH的质量为 g(3分)
⑶下列操作对所配浓度有何影响(填写字母)(每空3分)
偏大的有 ; 偏小的有 ;
无影响的有 。
A、称量用了生锈的砝码; B、将NaOH放在纸张上称量;
C、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D、往容量瓶转移时,有少量液体溅出 E、未洗涤溶解NaOH的烧杯
F、定容时仰视刻度线 G、容量瓶未干燥即用来配制溶液
H、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
10. (每空5分)⑴12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是 ,X的相对原子质量是 。
⑵下列所含分子数由多到少的排列顺序是
A.标准状况下33.6LH2 B.所含电子的物质的量为4mol的H2
C.20℃.45gH2O D.常温下,16gO2,与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
9.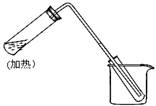 右图是用自来水制取少量蒸馏水的简易
右图是用自来水制取少量蒸馏水的简易
装置,(加热及固定仪器略),其原理与教材中
的实验完全相同。回答下列问题:
① 左边大试管中要加入几片碎瓷片,其作用是 ;(5分)
② 该装置中使用的玻璃导管较长,其作用是 . (3分)
③ 烧杯中还要盛有的物质是 (5分).
8.下列实验操作中: ①过滤 ②蒸发 ③溶解 ④取液体试剂 ⑤取固体试剂.一定要用到玻璃棒的是
A.①②③ B.④⑤ C.①④ D.①③⑤
将选择题答案填入下列表格
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com