
题目列表(包括答案和解析)
27.(12分) (1)若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是 g。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是
_ ,在相同温度和相同压强条件下,体积最大的是 ,体积最小
的是 。
(3)在 mL 0.2 mol/L NaOH溶液中含4 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O ____ g。
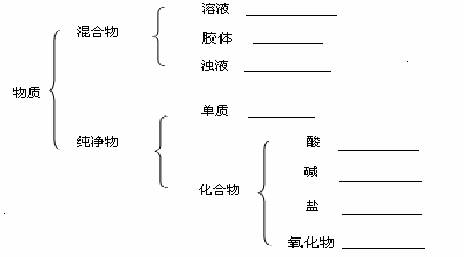
26. (12分) (1) 根据交叉分类法,请用斜线将下面框图的盐与盐的分类连接起来
KHS NaCl NaHSO4 Na2CO3
钠盐 酸式盐 无氧酸盐 含氧酸盐
(2)现有下列物质:A 豆浆、 B 食盐水、 C铁、 D 稀硫酸、 E 氢氧化 钠固体、 F 纯碱固体、 G 泥水、 H 二氧化碳、 I 水、 J H2SO4
请将它们的序号填充到下列横线上。
25.(6分) 下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其它成分未列出)
|
编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
名称 |
绿矾 |
醋精 |
苏打 |
酒精 |
铜导线 |
蔗糖 |
烧碱 |
|
主要成 分 |
FeSO4 |
CH3COOH |
Na2CO3 |
CH3CH2OH |
Cu |
C12H22O11 |
NaOH |
(1) 请你对表中①-⑦的主要成分进行分类(填编号)
属于电解质的是 ,属于非电解质的是
(2)写出②与⑦反应的离子方程式
27.向500ml盐酸中投入11.2克铁,二者恰好完全反应(忽略体积变化),计算:
(1)铁的物质的量。
(2)参加反应的HCl的物质的量和所得溶液的物质的量浓度。
(3)生成标准状况下H2的体积。
26.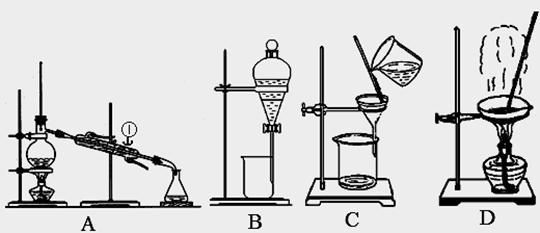 (8分)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(8分)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是 。
装置B在分液时为使液体顺利下滴,应进行的具体操作是
。
25.(8分)用18.4mol/L的浓硫酸配制100mL浓度为1mol/L的稀硫酸。
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里
D.检查100mL容量瓶,是否漏水
E.将蒸馏水直接加入容量瓶,至液面接近刻度线
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
请据此填写:
①完成上述步骤中的空白处。
②正确的操作顺序是(用字母填写):
( )→( )→( )→( )→( )→( )→( )。
③进行A步操作时,选用量筒的规格是
A.10mL B.50mL C.100mL D.1000mL
④如果对装有浓硫酸的量筒仰视读数,配制的稀硫酸浓度将 (填“偏高”、“偏低”、“无影响”)
⑤A步骤操作完成时,必须 后,才能进行后面的操作。
24.(每空2分,共8分)
(1)用离子方程式表达下列应用或现象
①向澄清石灰水中通二氧化碳气体变浑浊
②铝片和Hg(NO3)2溶液的反应
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①CuO +2H+=Cu2++H2o
②CO32-+ 2H+=CO2↑+ H2O
23.(每空2分,共6分)
(1)在9.5g某二价金属的氯化物中含0.2mol Cl-,此氯化物的摩尔质量为 ;该金属元素的相对原子质量为 。
(2)已知N2、CO2的混合气体的质量共10.0克,标准状况下,体积为6.72L,原混合气体中N2、CO2的体积之比 .
22.(共8分)某反应中反应物与生成物有: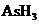 、
、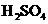 、
、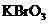 、
、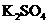 、
、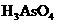 、Br2和。
、Br2和。
(1)配平上述化学反应方程式并标出电子转移的方向和数目:
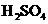 +
+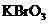 +
+ 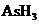 →
→ 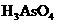 + Br2 +
+ Br2 + 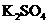 + H2O
+ H2O
(2)反应中,被还原的元素是 ,还原剂是 。
(3)根据上述反应可推知 。
a.氧化性: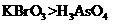 b.氧化性:
b.氧化性: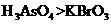
c.还原性: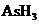 >Br2 d.还原性:
>Br2 d.还原性: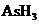 > Br2
> Br2
17.1 g ⑩溶于水配成250mL溶液,SO42-的物质的量浓度为 。
(4)少量的④通入⑥的溶液中反应的离子方程为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com