
题目列表(包括答案和解析)
2、NA为阿伏加德罗常数,下列说法正确的是
A. 10 g甲烷所含有的电子数目为10NA
B. 常温常压下,4 g氦气所含有的中子数目为4NA
C. 标准状况下,22.4 L单质溴所含有的原子数目为2NA
D. 电解食盐水若产生2 g氢气,则转移的电子数目为2NA
1、下列物质肯定为纯净物的是
A. 由一种元素组成的物质 B. 由一种原子组成的物质
C. 由一种分子组成的物质 D. 纯盐酸
24、(10分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解,试判断:
固体混合物中肯定有 ,肯定没有 ,可能有
对可能有的物质,可采用滤液中滴加 溶液方法来检验,写出检验的离子方程式
25(10分)、取少量Fe2O3 粉末(红棕色)加入适量的盐酸,所发生的离子反应方程式 ,反应后溶液呈 色。用此溶液进行以下实验:
⑴取少量溶液置于试管中,滴入NaOH溶液,可看到有红褐色沉淀生成,反应的化学方程式 。
⑵在小烧杯中加入20mL蒸馏水,加热至沸腾,向沸水中逐滴加入5-6滴FeCl3饱和溶液。继续煮沸,直至溶液呈 色,即可得Fe(OH)3胶体。
⑶把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察,可以看到 烧杯中的液体产生丁达尔效应。
26(12分)、现用18.4 mol /L的浓H2SO4来配制500 mL 0.2 mol /L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2 mol/L。请你分析配制过程中可能引起浓度偏高的原因(答出两点)_____________________、________________________。
27(10分)、将73g HCl溶于水,配成250mL溶液。
⑴计算所得溶液中Cl-的物质的量浓度。
⑵计算标准状况下HCl的体积。
⑶要使溶液中的H+全部中和,需要Ba(OH)2的物质的量。
23、(8分)书写下列反应的离子方程式
⑴大理石与稀盐酸反应制取CO2
⑵Zn与稀硫酸反应制取H2
⑶稀硫酸与氢氧化钡溶液反应
⑷CO2通入到足量的澄清石灰水中
22、(6分)在400mL 2mol/L H2SO4溶液中,溶质的质量是 ,此溶液中H+的物质的量浓度为 ,若加水稀释到1L,则SO42―的物质的量浓度为 。
21、(4分)SO42-的检验:先用 酸化,再滴加 溶液,若产生的白色沉淀,则说明有SO42-离子存在
20、在标准状况下,7.2g H2和CO的混合气体共8.96L,下列说法错误的是( )
A. H2和CO的物质的量之比为5:8 B. H2和CO的质量之比为1:14
C. H2和CO的体积之比为 5:8 D. H2和CO的密度之比为1:14
19、下列各组中的离子,能在溶液中大量共存的是
A. K+ , H+ , SO42― , OH― B. Na+ , Ca2+ , CO32― ,NO3―
C. Na+ ,H+ , Cl― , CO32― D. Na+ , Cu2+ , Cl― , SO42―
18、下列反应中,能用H+ + OH-=H2O表示的是( )
A.NaOH溶液和CO2的反应 B.Ba(OH)2溶液和稀H2SO4的反应
C.NaOH溶液和盐酸反应 D.氨水和稀H2SO4的反应
17、下列离子方程式正确的是( )
A.稀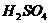 滴在铁片上:
滴在铁片上: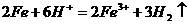
B.过量的CO2通入NaOH溶液中:CO2 +2OH-==CO32- + H2O
C.硫酸铜与氢氧化钡溶液混合: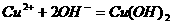
D.氧化铜与盐酸反应: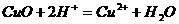
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com