
题目列表(包括答案和解析)
32、(1)有一瓶14%的KOH溶液,加热蒸发掉100g水,变成28%的KOH溶液80mL(无固体析出),则蒸发后溶液的物质的量浓度为 mol/L。
(2)已知某NaOH溶液(密度d=1.1g/mL)中n(Na+) : n(H2O) = 1:20, 则溶液中NaOH的物质的量的浓度各为多少?
31、有下列离子:K+、Mg2+、Ba2+、Cu2+、Na+、CO32-、SO42-、OH-、 NO3-、Cl-等按其在溶液中大量共存的原则,将上述离子等分成二组(要求每组不少于两种阳离子和两种阴离子,每种离子只能用一次),已知甲组溶液显碱性,则两组离子分别是:
甲____________________________ 乙 ___________________________
30、有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol。根据下表信息,回答有关问题:
|
|
溶质的质量分数 |
溶液的密度(g·cm-3) |
|
第一份溶液 |
ω1 |
ρ1 |
|
第二份溶液 |
ω2 |
ρ2 |
⑴第一份溶液中,溶质的物质的量浓度为 。
⑵取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3= 。
⑶若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小?① ② 。
29、(1)按要求写出微粒符号
① 钙离子的结构示意图: ,
② 质子数为16,中子数18的原子
③ 在1-20的元素中,最外层电子数是次外层电子数一半的元素 。
(2 )用双线桥标出下列化学方程式的电子转移数目和方向
2KMnO4 + 16HCl = 2KCl +5Cl2 + 2MnCl2 + 8H2O
该反应过程中, 氧化剂 , 还原产物
还原剂 ,氧化产物
(3)写出正确的化学方程式
实验室制取氯气 ;
漂白粉放置在空气中变质 。
28、现从固体KOH出发配制0.1mol/L 的KOH溶液 500mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
(2)如果在定容时仰视操作,则所配得溶液的浓度 0.1mol/L(填> , = , <)
(3)若所用的固体KOH中混有NaOH,则所配得溶液的OH-浓度 0.1mol/L
(填> , = , <)
(4)若用250mL的H2SO4溶液恰好能将此500mL 0.1mol/L 的KOH溶液中和,则该硫酸的物质的量浓度为 mol/L
27.(1)写出以下两种仪器的名称:
 A:
A:  B:
B:
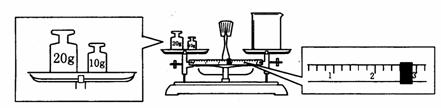
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧
杯的实际质量为_________g.
(3)指出下面实验中存在的错误:

26、将0.4mol MnO2和100mL 12mol/L盐酸混合后缓缓加热,向反应后留下的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量(不考虑盐酸的挥发)
A.等于0.6mol B.小于0.6moL C.大于0.6mol 而小于1.2mol D.以上结论都不对
25、已知卤素在水溶液中可发生如下反应:2KX + Y2 = 2 KY + X2 ,则X和Y可能分别是
A.Br和Cl B.Br 和I C.Cl 和 I D.Cl 和F
24、将钠、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体体积比
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
23、下列几种方法制备O2:①KClO3 和MnO2共热;②H2O2中加MnO2;③KMnO4受热分解。若要制相同质量的O2,则上述反应中相关物质转移的电子数之比为
A.3: 2:4 B.1: 1:1 C.2: 1:2 D.1: 1:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com