
题目列表(包括答案和解析)
5.下列物质中所含的分子数相等的是 ( )
①0.1molCO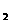 ②9.8gH
②9.8gH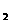 SO
SO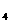 ③1gH
③1gH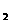 O ④1.6gO
O ④1.6gO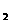
A.①② B.②③ C.①④ D.③④
4.某气体物质质量为6.4g,含有6.02×10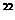 个分子,则该气体的相对分子质量是
( )
个分子,则该气体的相对分子质量是
( )
A.64 B.32 C.96 D.124
3.
含3.01×10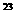 个分子的H
个分子的H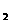 SO
SO 的物质的量是
(
)
的物质的量是
(
)
A.5mol B.0.5mol C.50mol D.0.2mol
2.下列仪器:①漏斗;②燃烧匙;③蒸馏瓶;④天平;⑤分液漏斗;⑥量筒。其中常用于分离物质的仪器是 ( )
A.①③④ B.①②⑥ C.①③⑤ D.③④
1.在下列实验操作中一定要用到玻璃棒的是 ( )
①过滤②蒸发③溶解④取液体试剂⑤取固体试剂
A.①②③ B.④⑤ C.①④ D.①③⑤
40.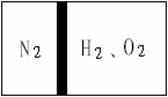 (5分)常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4(如图)。然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。求反应前H2和O2的物质的量之比。
(5分)常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的1/4(如图)。然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。求反应前H2和O2的物质的量之比。
39.(6分)有一瓶澄清溶液,可能含有NH4+、K+、Mg2+、Ba2+、 Al3+、Fe3+、SO42-、CO32-、NO-3 、
Cl- 、I- ,先进行如下试验:
①测知溶液显强酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层为紫红色;
③另取样品滴加稀NaOH溶液,使溶液变为碱性,此过程无沉淀生成,;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
原溶液中肯定存在的离子是 ;肯定不存在的离子是 ;
不能确定是否存在的离子是 。
38. (10分)配制1.50mol·L-1的NaOH溶液100mL:
(1)某学生操作如下:①用托盘天平称出6.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,再于左盘放粒状氢氧化钠,右盘放上砝码至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸。
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线。
③写出一个标有配制日期的“0.25mol·L-1NaOH溶液”的标签,贴在容量瓶上密闭保存。指出上述操作中的7处错误:
(1)__________________________;(2)_________________________
(3)__________________________;(4)_________________________
(5)__________________________;(6)_________________________
(7)__________________________
(2)下列操作造成所配溶液浓度偏高的是( )
A.所用NaOH已经潮解; B.用带游码的托盘天平称NaOH时误用了“左码右物”方法
C.未润洗溶解用的烧杯里; D.未冷却到室温就注入容量瓶
E.定容时,俯视视刻度线; F.托盘天平的砝码已生锈
37.(14分)(1)1molN含有 mol质子 (2)1.7gH2O2含有的原子数为 NA
(3)1molNa+含有 mol电子 (4)2.4g金属镁变成Mg2+失去电子数为 个
(5)用NA代表阿伏加德罗常数的值,如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是 L
(6)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
a.该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______ _。
b.该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____ mol·L-1。
36.(8分)写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3): (2)制备氢氧化铁胶体:
(3)硫酸铜溶液和氢氧化钡溶液混合: (4)向足量澄清石灰水中通入二氧化碳:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com