
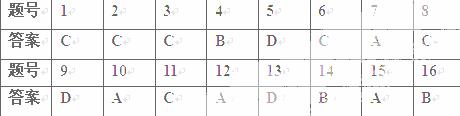
题目列表(包括答案和解析)
1.下列物质属于非电解质的是( )
A.C2H5OH B.CaCl2 C.H2SO4 D.金属铜
17 (6分) (1) 2 (2)1.5mol, 1.5mol/L
18 (4分)(1)分馏(蒸馏)(2分)
(2)向漏斗中加入少量水,体积增大的液层是水层。(2分)
19 (10分)(1)化合物(2分), ②⑤(3分) (2)能(2分),易分解(3分)
20(9分)(1)①④⑤⑥(2分);药匙、胶头滴管;(2分)
(2)搅拌;引流(2分)
(3)②①③⑧⑤⑥④⑦④(3分)

17 (6分)(1)1mol/L的CaCl2 溶液0.5L,Cl- 离子的物质的量浓度为___________mol/L
(2)标准状况下,33.6L的NH3所具有的物质的量为_________mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L
18 (4分)就有关物质的分离回答下面的问题
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
|
物质 |
熔点/oC |
沸点/oC |
密度/g·cm-3 |
溶解性 |
|
A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
|
B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是:
(2)在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。答:
19(10分)下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。請根据此表,结合中学学过的化学知识,回答下列问题:
|
配料表 |
精制海盐、碘酸钾(KIO3) |
|
含碘量 |
20―40mg/kg |
|
储藏方法 |
密封避光、防潮 |
|
食用方法 |
烹调时待食品熟后加入碘盐 |
(1)据物质分类中的树状分类法有关知识,在①HIO3 ②碘酸钠 ③KOH ④I2O5 ⑤NaCl五种 (填“混合物”或“化合物”或“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的有 。(填序号)
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3) 溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时 。
20 (9分)实验室制配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯
②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒
⑥托盘天平(带砝码) ⑦滴定管
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是___ 。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_______________ 。
21 (13分)四只试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,就如何检验这四种溶液分别解答下列各题。
在四支试管中分别取四种溶液各1mL,做下列实验。
(1)在四支试管中分别滴入 ,现象是
离子方程式是 。
(2)在剩余三支试管中分别滴入 ,现象是
离子方程式是 。
(3)在剩余两支试管中分别滴入 ,现象是
离子方程式是 。
三次实验中都没有明显现象的是 。
三 计算题(本题包括1小题,共10分)
22 (10分)将6.50 g锌投入200 mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:(Zn:65)
(1)6.50 g锌的物质的量
(2)所用盐酸中HCl中的物质的量浓度
(3)反应中生成的H2在标准状况下的体积高一化学(必修1)期中考试试题答案
第Ⅰ卷 选择题(共48分)
一 选择题(每题只有一个选项符合题意,每小题3分,共48分)
第Ⅱ卷 (非选择题 共52分)
1 据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系( )
A 乳浊液 B 溶液 C 胶体 D 悬浊液
2 设阿伏加德罗常数为NA,则下列说法正确的是( )
A 甲烷的摩尔质量为16克
B 标准状况下,0.3molSO2中含氧原子数为0.3NA
C 常温下,2.7克铝离子所带的电荷数为0.3 NA
D 常温下,9.5克MgCl2晶体中含Mg2+为0.2 NA
3 氯化铁溶液和氢氧化铁胶体具有的共同性质是( )
A 分散质粒子直径都在1-100nm之间
B 都能通过半透膜
C 都能通过滤纸
D 都呈红褐色
4 在酸性溶液中,可大量共存的离子是( )
A K+ Na+ OH- SO42- B Mg2+ SO42- NH4+ Cl-
C K+ Na+ HCO3- Cl- D K+ Na+ NO3- CO32-
5 Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )。
A.Na2CO3是碳酸盐 B.Na2CO3是盐
C.Na2CO3是钠盐 D.Na2CO3是碱
6 遇到下列情况,处理不当的是( )
A 不小心将少量浓硫酸沾到皮肤,立即用水冲洗。
B 皮肤上沾有浓碱溶液时,立即用酒精冲洗。
C 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中。
D 连接并组装成套仪器时,一般按自下而上、从左到右的顺序进行安装。
7 下列叙述正确的是( )。
A.0.012 kg12C含有6.02×1023个碳原子
B.1 mol任何物质都含有6.02×1023个原子
C.硫酸的摩尔质量是98 g
D.常温常压下,1 mol氧气的体积为22.4 L
8 除去NaCl中混有的 MgCl2、Na2SO4时选用( )
A NaOH、Ba(NO3) 2 、Na2CO3 、HCl
B Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl
C NaOH、BaCl2 、Na2CO3 、HCl
D Na2CO3 、BaCl2、HCl
9 下列离子方程式正确的是( )
A 澄清的石灰水与盐酸反应 Ca(OH) 2 + 2H+ = Ca2+ + 2H2 O
B 钠与水的反应 Na + 2H2 O = Na+ + 2OH- + H2↑
C 铜片插入硝酸银溶液 Cu + Ag+ = Cu2+ + Ag
D 大理石溶于醋酸 CaCO3 + 2 CH3COOH = Ca2+ + 2 CH3COO- + H2O + CO2↑
10 如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是( )
A. L B.
L B.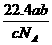 L C.
L C.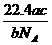 L D.
L D.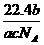 L
L
11 用等体积的0.1mol/L的BaCl2 溶液,可使相同体积的Fe2 (SO4 )3 、 Na2 SO4 、 KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
A 3:2:3 B 3:1:2 C 2:6:3 D 1:1:1
12 下列物质中属于非电解质的是( )。
A.乙醇 B.O2 C.Na2CO3 D.NaOH
13 离子方程式H++OH-=H2O所表示的反应是( )
A.所有酸和碱之间的中和反应
B.所有强酸和强碱之间的中和反应
C.所有可溶性酸和可溶性碱之间的中和反应
D.强酸溶液与强碱溶液生成可溶性盐和水的反应
14 对于相同物质的量的SO2和SO3,下列说法中正确的是( )
A 氧元素的质量比为1∶1 B 分子数之比为1∶1
C 原子总数之比为1∶1 D 质量之比为1∶1
15 下列物质中属于电解质的是( )
A H2 O B CO2 C NaCl溶液 D Fe
16 除去FeCl2溶液中少量的FeCl3,最好的办法是( )。
A.加入氢氧化钠溶液 B.加入铁粉
C.加入铜粉 D.通入氯气
第Ⅱ卷 (非选择题 共52分)
25、(6分)有 和
和 的混合气体共5.04L(STP),点燃恰好可以完全反应,通过计算回答:
的混合气体共5.04L(STP),点燃恰好可以完全反应,通过计算回答:
①混合气体中 和
和 的物质的量各是多少摩?
的物质的量各是多少摩?
②将生成的二氧化碳气体通入足量的浓度为0.5
 溶液中充分反应,则消耗该
溶液中充分反应,则消耗该 溶液的体积是多少升?
溶液的体积是多少升?
24、(10分)用18mol/L浓硫酸配制480ml 1.0mol/L稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③稀释④转移、洗涤⑤定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 。
A、10ml B、25ml C、50ml D、100ml
(2)实验需要的仪器除容量瓶、烧杯、量筒外,还需要 。
(3)第③步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响(用偏大、偏小、无影响填写)
A、所用的浓硫酸长时间放置在密封不好的容器中 。
B、容量瓶用蒸馏水洗涤后残留有少量的水 。
C、未冷却至室温立即转移并定容
D、定容时俯视溶液的凹液面
23、(8分)某学生应用下图所示的装置来研究物质的性质,其中气体X是含有空气和水蒸气的氯气。请回答下列问题:

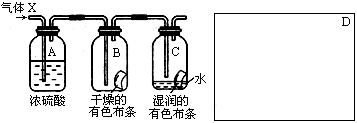
(1)该项研究(实验)的主要目的是 。
(2)与研究目的直接相关的实验现象是 。
(3)该实验装置设计上存在的缺陷为 ,合理的设计方案应在方框中添加盛有__________溶液的烧杯
(4) 要达到同样的实验目的,A、B、C的连接顺序还可以改变为_______________________,
若将X气体通到湿润的蓝色石蕊试纸上,能观察到的现象是_____________________
22、(1)、NaHSO4在溶液中的电离方程式为:
(2)、向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为
(3)、向NaHCO3溶液中滴加过量的Ba(OH)2溶液 ,其离子方程式为
21、①在Fe3O4 +4CO 3Fe+4CO2的反应中, 是氧化剂, 是还原剂,__________元素被氧化,________元素被还原。
3Fe+4CO2的反应中, 是氧化剂, 是还原剂,__________元素被氧化,________元素被还原。
②用双线桥或单线桥标出电子转移的方向和数目:2Na2 O2+2H2O= 4NaOH+ O2↑
20、(4分) 有Na2O2、Na2CO3、NaHCO3混合物共10g,将其投入200mL 1mol/L的盐酸中恰好完全反应,后将溶液蒸干,最终得到的固体物质的质量为________g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com