
题目列表(包括答案和解析)
21.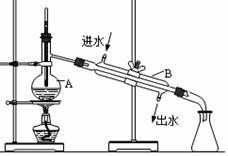 (5分) 右图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(5分) 右图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)图中的两处明显的错误是
① : __________________________ ;
②_________________________________。
(2)A仪器的名称是____________,B仪器
的名称是_______________。
(3)实验时A中除加入少量自来水外,
为防止液体暴沸还需加入少量_______。
20.(8分)Cu2S和稀HNO3反应生成Cu(NO3)2、H2SO4、NO和H2O,试解答下列各题
(1)配平上述反应方程式并标出电子转移的方向和总数
(2)当产生0.1mol NO时,转移电子总数为 ,被还原的物质为 mol,共耗HNO3 mol。
(3)被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是 mol
19.(5分)在锥形分液漏斗中加入10 mL 色碘水,然后再注入4 mL CCl4,盖好玻璃塞,按操作规则反复振荡后静置观察到的现象是:
操作完毕后,油层(即CCl4层)应从锥形分液漏斗的 口(填“上”或“下”)放出或倒出,为得到碘并回收CCl4可用 法。
18.(6分)根据物质的组成和性质特点,运用树状分类法对下列物质进行分类:钠(Na)、氯气(Cl2)、盐酸、硫酸(H2SO4)、碳酸钙(CaCO3)、氧化钠(Na2O)、氢氧化钠(NaOH)、空气
17.(6分)某溶液中可能含有SO42―、CO32―和NO3―,为了检验其中是否含有SO42―,正确的操作方法是取少量溶液置于试管中为排除干扰应先加:
再加
可能发生的离子反应方程式是:
16、1 mL密度为0.93 g·cm―3的氨水恰好中和0.005mol H2SO4生成(NH4)2SO4,若要配制上述浓度的氨水,在1L水中需要溶解标准状况下的氨气( )
A、294.7 L B、378.0 L C、2240.0 L D、1120.0 L
第Ⅱ卷 (非选择题 共52分)
15.在100 mL 0.10 mol/L的 AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4 · 5H2O的溶液,充分反应。下列说法中正确的是( )
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02 mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.10 mol/L
14.在标准状况下① 6.72 L CH4 ② 3.01×1023个HCl分子 ③ 13.6 g H2S ④ 0.2mol NH3,
下列对这四种气体的关系从大到小表达正确的是( )

|
 c.质量②>③>①>④
d.氢原子个数①>③>④>②
c.质量②>③>①>④
d.氢原子个数①>③>④>②
 A.a b c B.b
c d
C.a
b c d
D.a
c d
A.a b c B.b
c d
C.a
b c d
D.a
c d
13、在Na2SO4、NaCl、NaOH的混合溶液中,含有的Na+、SO42―、OH―个数比是8:1:2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比为( )
A、1:4:2 B、1:2:4 C、1:1:1 D、1:3:2
12.欲配制密度为1.10 g·cm-3、浓度为6 mol·L-1的稀盐酸,在体积为100 mL、密度为1.19 g·cm-3、浓度为12 mol·L-1的浓盐酸中需加蒸馏水( )
A.200 mL B.100 mL C.101 mL D.120 mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com