
题目列表(包括答案和解析)
7、配制0.1mol/L硫酸铜溶液,下列操作方法可行的是
A.将16g硫酸铜固体溶解在1L水中
B.将8g硫酸铜晶体溶解在一定量水中,再稀释至500mL
C.将0.2mol/L 100mL硫酸铜溶液与100mL水混合均匀
D.将5mol/L 10mL硫酸铜溶液与2mol/L 25mL硫酸铜溶液混合再加水稀释至1L
6、下列有关叙述中,不符合科学事实的是
A.“水滴石穿”的原因之一是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2
B. 实验室中的“通风橱”不能从根本上防止污染,因为它没有将实验产生的有害气体进行转化或吸收
C.“雨后彩虹”是一种光学现象,它与胶体的性质有关
D.“纯净水”中不含有任何化学物质
5、下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③少量的澄清石灰水加到过量的NaHCO3溶液中 ④ Na2O2投入FeCl2溶液中
A.①④ B.②③ C.①③④ D.①③
4、下列实验操作中错误的是
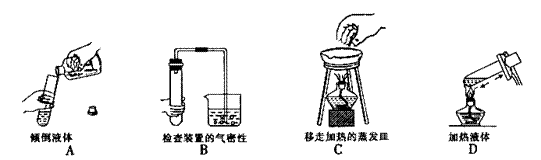
3、将一块银白色的金属钠放在空气中会发生一系列的变化,表面迅速变暗→“出汗” →变成白色固体(粉末),下列有关叙述不正确的是
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
2、两个体积相同的容器,一个盛有CO,另一个盛有N2和O2,在同温同压下,两容器内气体一定具有相同的
A.原子总数 B.电子总数 C.相对分子质量 D.质量
1、“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是
A.有丁达尔效应 B.能全部透过半透膜
C.不能透过滤纸 D.所得分散系不稳定
23.(7分)、四只试剂瓶中分别装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液、NaCl溶液,根据要求检验这四种溶液,并回答下列问题。
要求:①四种待测溶液只取一次作为样品检验。
②每次只检验出一种待测溶液。
四种溶液被检出的先后顺序是: 、 、 、 ;加入试剂的化学式依次是: 、 、 。
24(5分).现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25 ml沸水中逐滴加入5-6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
⑴其中操作正确的同学是 。
 ⑵证明有Fe(OH)3胶体生成的实验操作是
⑵证明有Fe(OH)3胶体生成的实验操作是
。
⑶丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带 电荷,Fe(OH)3胶体 (填“带”或“不带”)电荷。
②向其中加入饱和Na2SO4溶液,产生的现象是 。
25(12分).欲配制1mol/L的氢氧化钠溶液250mL, 完成下列步骤:
(1) 用天平称取氢氧化钠固体________g。氢氧化钠固体应放在 中称量。若称量时间过长,会导致所配溶液浓度 。(填“偏高”“偏低”“无影响”)
(2) 向________中加约30ml蒸馏水将其溶解,待_____ ___后,将溶液沿________移入__ ______。
(3) ………。若没有进行洗涤,会导致所配溶液浓度 。(填“偏高”“偏低”“无影响”)
(4) 向容量瓶内加水至刻度线________时,改用________小心加水至溶液 。若定容时俯视读数,会导致所配溶液浓度 。(填“偏高”“偏低”“无影响”)
(5)………。
26(11分).据中国质量新闻网 2010-01-29报道,有一种被称为洗虾粉的化学制剂被普遍用于龙虾的清洗。该物质不仅效果明显,而且洗涤效率高。有研究表明这种洗虾粉是一种工业领域普遍使用的除锈剂--草酸,是有机弱酸,其酸性为醋酸的10000倍。草酸对人体健康有危害,长期微量摄入,会在体内生成草酸钙沉淀,导致肾结石;摄入量较大,会影响人体内的酸碱平衡,严重者可导致死亡。洗虾粉中的主要功效成分是草酸。草酸又名乙二酸,是最简单的二元酸。晶体的化学式是H2C2O4·2H2O,主要用作还原剂和漂白剂。草酸不稳定,受热易分解生成CO和CO2等。草酸晶体受热分解时H2C2O4溶于自带的结晶水中。草酸具有很强的还原性,与氧化剂作用易被氧化成二氧化碳和水,可以使高锰酸钾(KMnO4)溶液褪色,被还原成+2价锰。
根据以上材料,回答下列问题:
(1) 写出草酸溶液与过量的澄清石灰水反应的离子方程式:
。
(2) 某研究性学习小组取少量的草酸晶体于试管中加热,分析验证其分解产物,可能用到的装置如下:
 |
|||||||
|
|
||||||
|
|||||||

①根据草酸晶体受热分解的特点,应选用 (填“A”或“E”)。你选择的理由是: 。
②写出H2C2O4受热分解的化学方程式(注明条件等):
。
根据实验要求,可能要用到C装置两次。C装置两次作用中,应先后装入的药品分别是 和 。
(3) 已知草酸与酸性高锰酸钾溶液反应的化学方程式:
5H2C2O4 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4+ 10CO2 ↑+ 8H2O
①用单线桥表示该反应的电子转移方向和数目。
②该反应中,KMnO4被 ,CO2是 产物。
③当生成标准状况下的CO2气体6.72L时,转移电子的物质的量为 。
27(8分).常温下,将20.0g14.0%的NaCl溶液跟30.0g24.0%的NaCl溶液混合,得到密度为1.15g·cm-3混合溶液。计算:
(1)该混合溶液中NaCl的质量分数;
(2)该混合溶液中NaCl的物质的量浓度;
(3)在1000g水中加入NaCl的质量为多少克时,才能使其浓度与上述混合溶液浓度相等。
成都市七校协作体高2013级第一学期期中试题
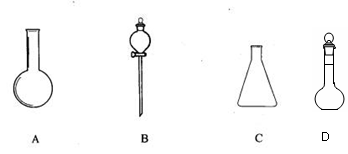 21(4分).有下图所示A、B、C、D四种仪器:
21(4分).有下图所示A、B、C、D四种仪器:
请选择下列仪器名称的序号,填入相应的空格内:
①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗 ⑥容量瓶
A ______________ B______________C______________D______________
22.(8分)现有下列物质:①盐酸②氢氧化钠③亚硫酸钙④氯化钾⑤水银⑥冰水⑦大理石⑧CuSO4•5H2O⑨Na2O2⑩氯化铵
根据物质的组成和性质分类填空:
(1) 单质: (2)难溶于水的物质:
(3)混合物: (4)由三种元素组成的物质:
(5)写出②在⑥中电离的方程式:
(6)写出①的水溶液与⑦反应的离子方程式: 。
20.同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的相对分子质量为A
A.28 B.60 C.32 D.4
第II卷 (共四个大题,共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com