
题目列表(包括答案和解析)
22.(21分)已知HClO  H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
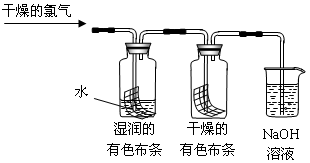
(1)通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此甲同学认为:干燥的氯气 漂白性,潮湿的氯气 漂白性(填“有”或“没有”)。
(2)细心的乙同学发现,一段时间后干燥的有色布条也褪色了。他经过仔细思考,认为甲的设计有缺陷,应该作如下修改: 。
(3)烧杯中NaOH溶液所起的作用是 ,
烧杯中所发生反应的化学方程式为 。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时5分钟,小烧杯中盛2 mol·L-1的NaOH溶液的体积至少应为 mL。
(5)丙同学按照乙同学的方案修改后,补做了盐酸加入到有色布条,发现有色布条不褪色。丙同学确认是HClO使有色布条褪色,但丁同学认为还是不能确认HClO使湿润的有色布条褪色,他认为还应增加的实验是: 。
w.w.^w.k.&s.5*高.考.资.源.网
第Ⅱ卷(选做题,53分)
友情提醒:本部分试卷分为A、B两类,同学们可以选做A、B两类中任何一类,但选择要统一,不可两类混做,多做或混做均不得分。
A类题
21.(16分)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
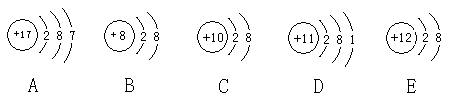
(1)属于离子结构示意图的是 、 (填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同) ,最容易失去电子的原子是 ,最容易得到电子的原子是 。
(3)A、B、D三种元素形成的一种化合物在水溶液中的电离方程式 。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号 、 。
20.氯气(Cl2)和氧气(O2)都是活泼的非金属单质,在一定条件下它们都能跟甲烷(CH4)反应。已知O2和CH4充分反应后的生成物是CO2和H2O,由此推断Cl2和CH4充分反应后的生成物是
A.CCl4和HCl B.CCl4和H2 C.CH2C12和H2 D.C和HCl
19.含MgCl2、FeCl3、Al2(SO4)3三种溶质的混合溶液中,已知Cl-为1.5mol,Al3+和Fe3+共0.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.1mol B.0.5mol C.0.25mol w.w.^w.k.&s.5*高.考.资.源.网D.0.15mol
18.
 单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为 : ①SiO2 + 2 C
单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为 : ①SiO2 + 2 C  Si + 2 CO
Si + 2 CO
②Si + 2Cl2 SiCl4 ③SiCl4 + 2H2 Si + 4HCl,其中反应①和③都属于
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
17.下列过程应用于工业生产的是w.w.^w.k.&s.5*高.考.资.源.网
A.钠在氯气中燃烧制氯化钠 B.氢气与氯气光照条件下制氯化氢气体
C.浓盐酸与二氧化锰共热制氯气 D.氯气与石灰乳反应制漂白粉
16.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.22.4 L 氢气中含有氢分子数目为NA
B.1 mol 臭氧(O3)中含有氧原子的数目为2NA
C.常温常压下,14 g 氮气含有的原子数目为 NA
D.0.5 mol/L Fe2(SO4)3 溶液中,SO42-的数目为1.5NA
15.下列说法正确的是
A.待测液中加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,则待测液中一定有硫酸根离子
B.用灼烧的方法可鉴别丝绸与棉布
C.无色溶液中加入Na2CO3溶液产生白色沉淀,则该无色溶液中含有Ca2+
D.待测液中加入AgNO3溶液,有白色沉淀生成,则待测液中含有Cl-
14.下列溶液中的Cl-浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是
A.150 mL 1 mol·L-1 NaCl溶液 B.75 mL 0.5mol·L-1 CaCl2溶液
C.150 mL 2 mol·L-1 KCl溶液 D.75 mL 1 mol ·L-1 FeCl3溶液
13.
 已知最外层电子数相等的元素原子具有相似的化学性质。下列原子中,与氧元素原子化学性质相似的是
已知最外层电子数相等的元素原子具有相似的化学性质。下列原子中,与氧元素原子化学性质相似的是
A.氖 B.碳 C.镁 D.硫
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com