
题目列表(包括答案和解析)
25.(16分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)  该浓盐酸中HCl的物质的量浓度为
mol/L。
该浓盐酸中HCl的物质的量浓度为
mol/L。
(2) 取用任意体积的该盐酸溶液时,下列物理量中不随所取 体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3) 某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500 mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2 cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是 。
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4) 现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L;向所得混合溶液中加入5.3 g Na2CO3固体,充分反应后,溶液中生成沉淀的质量有_________g。
(5) 在标准状况下,将______________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得盐酸的密度为1.2 g/cm3,溶质质量分数为36.5% 。(保留小数点后一位)
(命题人:蒋邦龙 审题人:李 平)
西南师大附中2010-2011学年度上期期中考试
24.(4分) 下列说法中正确的是____________(多项选择)
A.将25 g CuSO4·5H2O晶体加入到100 mL水中,该溶液物质的量浓度为1 mol/L
B.将100 mL 5 mol/L盐酸在蒸发皿中蒸发至50 mL溶液,物质的量浓度变为10 mol/L
C.将10 mL 0.1mol/LNaCl溶液与90 mL水混合,所得溶液物质的量浓度约为0.01mol/L
D.实验室要用容量瓶配制0.2 mol/L的NaCl溶液960 mL,应称量NaCl固体11.2 g
E.恰好完全中和100 mL 0.5 mol/L的H2SO4溶液,需NaOH固体4 g
23.(13 分) 有一包固体粉末,由CaCO3、Na2SO4、KCl、Ba(NO3)2、CuSO4中的三种物质组成,取样品进行如下实验:
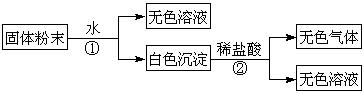
(1) 写出实验过程中发生反应的离子方程式 。
(2) 固体粉末中一定不存在的物质是 ,一定存在的物质是 。
(3) 将固体粉末可能的组合填入下表:(可以不填满,也可以再补充)
|
序号 |
化学式 |
|
Ⅰ |
|
|
Ⅱ |
|
|
Ⅲ |
|
(4) 请设计一个实验进一步确定混合物的组成,简述实验步骤、现象和结论。
_________________________________________________________________________。
22.(11分) 某同学在学校实验室里发现两瓶失去标签的溶液(标记为A、B),经询问实验员得知是稀硫酸和小苏打(NaHCO3)溶液。为了区分它们,该同学进行了如下实验,请你协助他完成相关问题的解答:
(1) 取少量A、B两溶液,分别加入适量Na2CO3,观察到A中有大量气泡,B中没有明显变化现象。A溶液中发生反应的化学方程式是__________________________________。
(2) 取少量A、B两溶液,分别加入几滴酚酞试液,A仍为无色,B为浅红色,分别再逐滴加入过量的NaOH溶液,A中的现象是___________________________,其离子方程式是_________________________________;B中的现象是_________________________, 其离子方程式是___________________________________________________________。
21.(12分) 某废液中主要含有NaCl、NaI,实验室从该废液中回收I2和NaCl的流程如下:
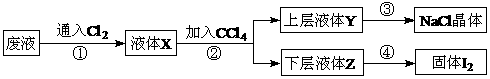
回答下列问题:
(1) 在步骤①中通入的Cl2与NaI发生置换反应生成I2,其反应的化学方程式为
__________________________________________________________________________。
(2) 步骤②操作名称是 ,用到的玻璃仪器有________________________。
(3) 下层液体Z的颜色是 ,步骤④操作的名称是 。
(4) 要从上层液体Y中得到NaCl晶体,步骤③操作中需要的实验仪器有_______________。
A.试管 B.蒸发皿 C. 漏斗 D.玻璃棒 E.坩埚 F.酒精灯 G.烧瓶
20.(13分) 下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:
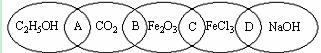
(1) 两种物质都是强电解质的是________(填分类标准代号,下同),两种物质都是氧化物的是________。
(2) 分类标准代号A表示______________(多项选择)
a.两物质都是非电解质 b.两物质都是有机物
c.两物质都是含碳化合物 d.两物质都是氧化物
(3) 上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,该反应的离子方程式为______________________________________________________________。
(4) 图中相连的两种物质可归为一类,又能相互反应的是________(填分类标准代号),其反应的基本类型是________________反应。
(5) 用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为_____________,该反应的化学方程式为_________________________________________________________________。
19.(9分) 某课外小组对一些金属单质和化合物的性质进行研究。下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
|
实验步骤 |
实验现象 |
|
Ⅰ |
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。充分反应后,过滤。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
Ⅱ |
滤液中加入少量的NaOH溶液。 |
有白色沉淀产生。 |
|
Ⅲ |
将所得红色固体用蒸馏水洗涤后,加热烘干。 |
少量红色固体变黑 |
Ⅰ反应的离子方程式 ,
Ⅱ反应的离子方程式 ,
Ⅲ反应的化学方程式 。
18. 将金属Mg、Fe的混合物16 g投入到200 mL的稀硫酸中,恰好完全反应,收集到标准状况下11.2 L 氢气。下列相关说法错误的是 ( )
A.Mg、Fe混合物总物质的量为0.5 mol
B.Mg与Fe物质的量之比为3︰1
C.生成MgSO4的质量为45 g
D.该稀硫酸物质的量浓度为0.5 mol/L
第Ⅱ卷 非选择题(共78分)
17. 下列离子方程式中,只能表示一个化学反应的是 ( )
①Fe + Cu2+=Fe2++ Cu
②Ba2++ 2OH-+ Cu2++ SO42-=BaSO4↓+ Cu(OH)2↓
③H++ OH-=H2O
④CO32-+ 2H+=CO2↑+ H2O
⑤Ag++ Cl-=AgCl↓
A.只有① B.只有② C.②④ D.③⑤
16. 欲除去粗食盐中的泥沙、CaCl2、MgCl2、Na2SO4 等杂质,现提供NaOH溶液和BaCl2 溶液两种药品,还需要的药品是 ( )
A.NaHCO3溶液、稀盐酸 B.Na2CO3溶液、稀盐酸
C.K2CO3溶液、稀硝酸 D.Ba(OH) 2溶液、稀硝酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com