
题目列表(包括答案和解析)
33.(8分)某学生计划用98%、密度为1.84g/mL的浓硫酸配制500mL0.2moL/L的稀硫酸。(经计算后)回答下列问题:
(1)浓硫酸物质的量浓度为 ,量取浓硫酸的体积为 mL 。
(2)配制时应选用量筒的规格为 (10mL、25mL、50mL、100mL);(除量筒和容量瓶外)还需要的仪器主要有 、 、 。
(3)其操作步骤如下,正确的操作顺序是 。
A 用量筒量取浓硫酸,缓缓注入装有一定量蒸馏水的烧杯中,并用玻棒搅拌
B 将稀释冷却至室温后的H2SO4小心地沿玻璃棒倒入容量瓶里
C 检查500mL容量瓶是否发生滴漏
D 将蒸馏水直接加入容量瓶,至液面接近刻度线1~2cm处
E 洗涤烧杯和玻璃棒2~3次,将洗液都倒入容量瓶中
F 盖紧瓶塞,反复颠倒振荡,摇匀溶液
G 用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低处恰好与刻度线相切
32.下列4组物质均有一种物质的类别与其它3种不同
A.CaO、Na2O、CO2、CuO B.H2、C.P、Cu
C.O2、Fe、Cu、Zn D.HCl、H2O、H2SO4、HNO3
(1)以上四组中与其它3种类别不同的物质依次是(填化学式) A ; B ; C ; D 。
(2)这四种物质相互作用可生成一种新物质(碱式碳酸铜,化学式为Cu2(OH)2CO3),
该反应 氧化还原反应(填“是”或“不是”)。
31.用单线桥标出下列反应中电子转移的方向和数目,并指出氧化剂和还原剂。
(1) Cl2 + SO2 + 2H2O = H2SO4 + 2HCl
氧化剂: , 还原剂: ;
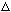 (2) C +
2H2SO4 (浓) == CO2↑ +SO2↑+ 2H2O
(2) C +
2H2SO4 (浓) == CO2↑ +SO2↑+ 2H2O
氧化剂: , 还原剂: ;
30.将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为:
A.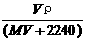 B.
B.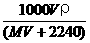 C.
C.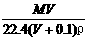 D.
D.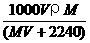
29. 为除去粗盐中Ca2+、Mg2+、SO42-及泥沙,将粗盐溶于水,然后进行下列操作:①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量的BaCl2溶液,正确操作顺序是( )
A. ①④⑤②③ B. ④①②⑤③ C. ②⑤④①③ D. ⑤②③④①
28. 吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂 B.作氧化剂 C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
27.在xR2++yH++O2=mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是:
A.m=4,R3+是氧化产物 B.m=y,R3+是氧化产物
C.m=2,R3+是还原产物 D.m=y,R3+是还原产物
26.向K2SO4和FeCl3混合溶液中滴入Ba(OH)2溶液,当SO42-完全沉淀时,Fe3+也沉淀完全,则原混合溶液中K2SO4和FeCl3的物质的量浓度之比为:
A.2 : 1 B.2 : 3 C.3 : 1 D. 3 : 2
25.将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为:
A.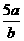 mol/L B.
mol/L B.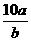 mol/L
C.
mol/L
C.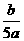 mol/L D.
mol/L D.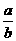 mol/L
mol/L
24.能用H+ + OH- = H2O 来表示的化学反应是( )
A.CuO溶于稀H2SO4 B.澄清石灰水和HNO3溶液反应
C.KOH溶液和醋酸溶液反应 D.Ba(OH)2溶液和H2SO4溶液反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com