
题目列表(包括答案和解析)
1、普通酒精中乙醇的含量为96%,15°C时密度为0.76g/cm3,将乙醇看作溶剂,水看作溶质,普通酒精中水的物质的量浓度是________________。
28.某试样X由氧化亚铁和氧化铜组成。取质量相等的两份试样按下图进行实验:

(1) 请写出步骤①中发生的全部反应的离子方程式___________________________
(2) 请写出步骤③ 中发生的全部反应的离子方程式
。
(3)若全部的溶液Y和全部的粉末Z充分反应生成不溶物W的质量为32g ,气体F在标准状况下体积为5.6 L,所得溶液的体积为200 mL,则每份试样X的质量 g,
所得溶液E中Fe2+ 的物质的量浓度为 mol/L。
附加题:
27.实验室配制500mL0.1mol/L Na2CO3溶液,[已知Na2CO3的式量106 ;Na2CO3·10H2O式量286 ]回答下列问题:
(1)应用托盘天平称取碳酸钠晶体[ Na2CO3·10H2O] g
(2)用托盘天平和小烧杯称取该质量的碳酸钠晶体,其正确操作顺序的标号为
(同一步骤可用多次)。
A.调整零点
B.向天平添加砝码和调整游码到指定质量
C.将碳酸钠晶体放入小烧杯中称量
D.称量空的小烧杯
E.将砝码放回砝码盒内
F.记录称量的结果
(3)将溶液转移到容量瓶中的正确操作是
(4)定容的正确操作是
(5)若实验遇到下列情况,溶液的浓度如何变?用“偏高,偏低、不变”填空
A.忘记将洗涤液转移入容量瓶 B. 定容时俯视标线
C.定容后摇匀液面低于刻度线____
26.把一小块金属钠放入盛水(滴有酚酞)的烧杯中,可以观察到金属钠浮在水面上,迅速熔化成闪亮的小球,发出嘶嘶的声音,并四处游动,直到消失。烧杯中的溶液变成红色。
通过分析这些实验现象,可以得出金属钠的具有如下的性质(写三条即可):
①_______________;②________________;③_______________;
若把金属钠放到硫酸铜溶液中,看不到红色固体生成,能观察到有蓝色和黑色沉淀生成,请写出发生的所有反应的化学方程式(是离子反应的写离子方程式):
_______________________________________________________________________
_______________________________________________________________________
25.在标准状况下,1体积水中可以溶解V体积氯化氢气体,制得密度为ρg/cm3的盐酸溶液,则所得盐酸溶液中溶质的质量分数为 ;溶质的物质的量浓度为 。
24.已知某反应中反应物与生成物有: HNO3、Cu(NO3)2、NO、Cu、H2O
(1)已知Cu在反应中失去电子,则该反应的氧化剂是 。
(2)该反应中,发生还原反应的过程是(写化学式) → 。
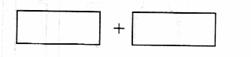 (3)将反应物的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(3)将反应物的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4) 如有1.5 mol Cu参加反应,有 mol HNO3参加反应,被还原的HNO3的物质的量是_________mol. 转移电子的物质的量是________ mol。
23.将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
(1)A组: ;B组: 。
(2)按要求写出A组与B组中离子相互反应的离子方程式
生成无色气体: _________ ,
没有明显现象: 。
22.(1)写出Fe2(SO4)3在水溶液中的电离方程式:
_________________________________________________________
(2)写出下列离子方程式对应的一个化学方程式:
2H+ + CO32- = H2O + CO2↑
_________________________________________________________
(3)用“双线桥法”标明电子转移的方向和数目。
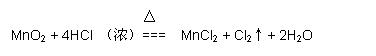 该反应中氧化剂与还原剂物质的量之比为_________________
该反应中氧化剂与还原剂物质的量之比为_________________
该反应的离子方程式为____________________________________________
(4)根据下列四个反应:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2 ④H2S+I2=S+2HI
可以判断FeCl3 、Cl2 、I2 、S四种物质的氧化性由强到弱的正确顺序是_________
21.请按要求填空:
(1)欲除去硝酸钾固体中混有的少量氯化钠固体,所进行的实验操作依次
是 、蒸发浓缩、降温结晶、 。
(2)欲除去氯化钠溶液中混有的硫酸钠,依次加入的溶液为(填溶质的化学式)
、 _________ 、 ________ 。
(3)除去混入NaCl溶液中少量CuSO4杂质选用的一种试剂是 ,
有关离子方程式为 。
20.在一定条件下,NO跟NH3可以发生反应:6NO + 4NH3 = 5N2 + 6H2O,该反应中被氧化和被还原的氮元素的质量比是(
A.3 :2 B.2 :1 C.1 :1 D.2 :3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com