
题目列表(包括答案和解析)
7.把0.05mol醋酸分别加入到下列100 mL溶液中,溶液的导电能力变化最明显的( )
A.0.5 mol/LNaOH溶液 B.0.5 mol/L盐酸
C.0.5 mol/L NH4Cl溶液 D.0.5 mol/L 氨水
6.下列叙述正确的是 ( )
A.氯气的水溶液能导电,所以氯气属于电解质
B.稀H2SO4溶液能导电,稀H2SO4是电解质
C.由于NH3·H2O溶于水,而Ca(OH)2微溶于水,所以NH3·H2O是强电解质,Ca(OH)2是弱电解质
D.硫酸钡难溶于水,但硫酸钡属于强电解质
5.150℃时, NH4HCO3分解为NH3、H2O、CO2三种物质,此时混合气的密度是相同
条件下的氢气密度的大约 ( )
A.26.3倍 B.15.25倍 C.13.2倍 D.12倍
4.设NA表示阿伏加德罗常数,数值约为6.02×1023。下列说法正确的是 ( )
A.2.4 g金属镁变成镁离子时失去的电子数目为6.02×1022
B.2 g氢气所含分子数目为2×6.02×1023
C.在25℃,1.01×105 Pa时,11.2 L氧气所含的氧原子数目为6.02×1023
D.标准状况下,以任意比混合的氢气和氧气混合物2.24 L,所含的分子数为6.02×1022
3.下列实验操作中,正确的是 ( )
A.利用丁达尔现象区别溶液和胶体
B.用滤纸过滤可以除去溶液中的胶体粒子
C.向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体
D.向Fe(OH)3胶体加入足量稀盐酸后,依然有丁达尔现象
2.NaHSO4在水溶液中能够电离出H+、Na+和SO42- 。下列分类中错误的是( )
A.NaHSO4是盐 B.NaHSO4是酸
C.NaHSO4是钠盐 D. NaHSO4是酸式盐
1.下列说法正确的是 ( )
A.在化学反应中某元素化合价升高,该元素一定被还原了;
B.金属单质在氧化还原反应中只能作还原剂;
C.在氧化还原反应中,非金属单质一定是氧化剂
D.有气体生成的化学反应一定是氧化还原反应
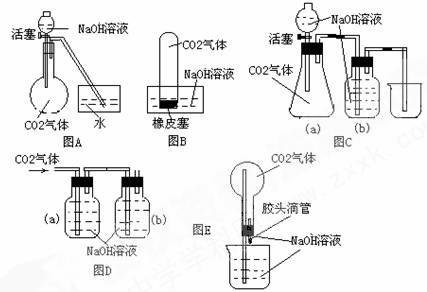
22.(30分)设计一个实验,能通过观察到的明显现象,说明CO2与NaOH溶液发生了反应。实验用品:集气瓶、烧瓶、分液漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品。现有五位同学设计了如图A-E五个装置,试回答:
(1)对图A,当将分液漏斗中的NaOH溶液滴入烧瓶时,如果看到水槽中的水被吸入到烧瓶中,则证明CO2与NaOH溶液发生了反应。请写出NaOH溶液与过量CO2反应的化学方程式:
(2)若用100mL 1mol/LNaOH溶液吸收0.06 mol CO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比为 。
(3)设NA为阿伏加德罗常数,下列关于0.2mol/L的Na2CO3溶液说法不正确的是
A.2L溶液中阴阳离子总数为0.8NA
B.500mL溶液中CO32-离子浓度为0.2mol/L
C.500mL溶液中Na+离子浓度为0.2mol/L
D.500mL溶液中CO32-物质的量为0.4NA
(4)对图B-E,请指出能达到实验目的的装置 (用B、C、D、E填空),并选出其中两种,说明能证明CO2与NaOH溶液发生了反应的操作及实验现象,将结果填入下表:
|
所选装置 |
操作方法 |
实验现象 |
|
|
|
|

21.(10分)两种物质A、B的混合物的质量为m,所含物质的量的和为n。已知A、B的摩尔质量分别为MA和MB。求混合物中A和B的物质的量。
以下为选做题:
20.(15分)将250C 101KPa条件下的氯化氢(HCl)气体49.6L,通入492mL水中,(已知水的密度为:1.00g/mL),得到密度为1.13g/mL的盐酸(即氯化氢的水溶液)。注:250C 101KPa条件下气体摩尔体积为24.8L/mol。(计算结果保留一位小数)
(1)求此盐酸的质量分数?(5分)
(2)求此盐酸的物质的量浓度?(5分)
(3)取出20.0 mL该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?(5分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com