
题目列表(包括答案和解析)
2、对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
1.下列事故处理方法正确的是
A.汽油失火时,立即用水灭火 B.钠着火时,用大量的水灭火
C.浓NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D.浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
21、计算题(12分)
用KMnO4氧化密度为1.19g/cm3,溶质质量分数为36.5%的HCl溶液,反应方程式如下:2KmnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O
(1)该HCl溶液的物质的量浓度是
(2)15.8gKMnO4能使 g HCl发生上述反应,有 g HCl被氧化。
(3)产生的Cl2在标准状况下的体积为 L。
20、(12分)晶体硅作为良好的半导体材料,是信息技术中的关键材料,工业上用焦炭在电炉中(高温)还原SiO2制得含少量杂质的粗硅,同时生成CO气体。碳化硅(SiC,俗称金刚砂)具有金刚石的结构,硬度大,可用作砂纸、砂轮的磨料,工业上使焦炭与SiO2在高温下反应制得碳化硅,同时生成CO气体。据以上内容回答:
(1)写出制取粗硅的化学方程式 在该反应中氧化剂与还原剂的物质的量之比为
(2)写出制取碳化硅的化学方程式 在该反应中氧化剂与还原剂的物质的量之比为
(3)在制取粗硅和碳化硅的工业生产中,从环境保护和废弃资源再利用的角度来看,可采取的比较理想的附加措施是
19、 (8分)氧化铜在高温下发生分解反应,其反应的化学方程式可表示为4CuO
2Cu2O+O2↑,试根据要求回答下列问题:
(8分)氧化铜在高温下发生分解反应,其反应的化学方程式可表示为4CuO
2Cu2O+O2↑,试根据要求回答下列问题:
(1)该反应中氧化剂为 ,还原剂为 。若反应过程中生成1个O2分子,则转移的电子数为 个。
(2)现将80gCuO灼烧,灼烧后固体质量变为73.6g,则该反应转移的电子数为
18、(8分)有一透明溶液,可能含有Al3+、Fe3+、K+、NH4+、Mg2+和Cu2+等离子中的一种或几种。现加入Na2O2粉末,只有无色无味的气体放出,并同时析出白色沉淀。加入Na2O2的量与生成白色沉淀的量之间的关系用右图来表示。
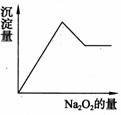 试推断:
试推断:
(1)原溶液中一定含有 离子
(2)一定不含有 离子
(3)可能含有 离子
(4)为了进一步确定可能含有的离子,应增加的实验操作为
17、(12分)已知下列物质的相互转化关系如下:
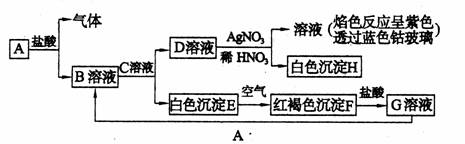
试回答下列问题:
(1)B的化学式为 ,D的化学式为
(2)写出由A转变成B的化学方程式
(3)用KSCN鉴别G溶液的现象为 ;向G溶液中加入A发生反应的离子方程式为
16、 现有AlCl3和MgSO4混合溶液,向其
现有AlCl3和MgSO4混合溶液,向其
中不断加入NaOH溶液,得到的沉淀的量与
加入NaOH溶液的体积如图,则原溶液中Cl-、
SO42-的物质的量之比为( )
A、1:1 B、2:3
C、3:2 D、6:1
15、某氯化镁溶液的密度为1.18g·cm-3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl-的物质的量约等于( )
A、0.37mol B、0.63mol C、0.74mol D、1.5mol
14、下列实验中,有白色沉淀产生且不再变化的是( )
A、把CO2通入澄清石灰水中至过量
B、把NaOH溶液逐滴滴加到Al2(SO4)3溶液中至过量
C、向AlCl3溶液中不断滴入氨水至过量
D、向FeSO4溶液中不断滴入NaOH溶液至过量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com