
题目列表(包括答案和解析)
25.某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 mL 5 mol/L HCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a的取值范围是_____________。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液。当沉淀质量达到最大值时,加入的NaOH溶液的体积是_____________mL,沉淀的最大质量是_____________g(用含a的代数式表示)
(3)继续加入NaOH溶液至沉淀质量不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数______________。
24.⑴加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。(列出计算过程)
⑵过氧化钠与铝粉混合物共18.3g,加入100ml 水,充分反应后混合物完全溶解,并收集到5.6L气体(标准状况).则收集到的气体成份是 ,体积比是 。
附加题(共8 分)
23.某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题:
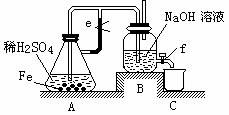
⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为: ,
B中可以观察到的现象是 。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是 。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是 ,
有关反应的化学方程式是
22.物质有以下转化关系:

根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是 ,B是 ,C是 ,X粉末是 。
(2)写出反应①的化学方程式 。
(3)写出反应②的离子方程式 。
21.某无色透明溶液,投入金属铝可放出H2。现有下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、
HCO3-、OH-。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
(1)当生成Al3+时,可存在的离子有 ;
(2)当生成AlO2-时,可存在的离子有 。
20. 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中MgCl2与
Al2(SO4)3的物质的量浓度之比为 ___________
19.⑴在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂; 元素被氧化; ________是氧化产物;7mol HCl参与反应时转移的电子总数为_____mol.
⑵反应11P +15CuSO4 +24H2O = 5Cu3P + 6H3PO4 +15H2SO4中32g CuSO4能氧化磷的质量为_________g.
18.工业上为了除去铝材表面的自然氧化膜,常常将铝材浸入装有NaOH溶液的碱洗槽中。 碱洗时常有气泡冒出,原因是________________________(用离子方程式表示).为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________.
a.NH3 b.CO2 c. NaOH d.HNO3
17.由地壳中含量最高的金属元素和非金属组成的化合物的名称是________,铁红常用于制造红色油漆和涂料,它的化学式是____________.
16.将一定量的Fe、Fe2O3和CuO的混合物,放入体积为100 mL物质的量浓度为2.2 mol/L的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28 g。过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL)。向滤液中加入2 mol/L NaOH溶液至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为
A.1.8 mol/L B.2 mol/L C.2.2 mol/L D.无法计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com