
题目列表(包括答案和解析)
26.(8分)为了测定某铜银合金的组成,将17.2g合金溶于50ml 的11.0mol/L 的浓硝酸中,待合金完全溶解后,只生成NO2和NO气体,共4.48L(标准状况下),并测得此时溶液中硝酸的物质的量浓度为1.0mol·L-1;假设反应后溶液的体积仍为50ml。已知:
Ag + HNO3 (浓)== AgNO3 + NO2↑+ H2O
3Ag + 4 HNO3 (稀) == 3AgNO3 + NO↑+ 2H2O; 试计算
(1)被还原的硝酸的物质的量
(2)合金中银的质量分数
 “华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
“华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
2010-2011学年上学期第三次月考
25.(12分)硫酸铵是一种常用的铵态氮肥。国家规定的质量标准如下:
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外 观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
某化学研究性学习小组同学在社会实践活动中,对某农用品商店出售的一等品硫酸铵化肥的品质进行检测。
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验检测]
(1)通常实验室检验某样品是否为铵盐,是将样品与 (填序号,下同)共热,并用
检验产生的气体。
 A.强酸 B.强碱 C.湿润的红色石蕊试纸 D.湿润的蓝色石蕊试纸
A.强酸 B.强碱 C.湿润的红色石蕊试纸 D.湿润的蓝色石蕊试纸
E.用蘸有浓盐酸的玻璃棒 F.用蘸有浓硫酸的玻璃棒
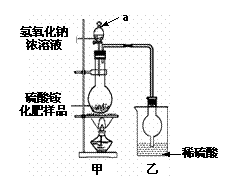
(2)若按右图所示装置进行实验。
烧瓶内发生反应的离子方程式为:
,
(3)实验过程中,需往烧瓶中加入足量浓氢氧化钠
溶液并充分加热,原因是:
。
[交流讨论]
(4)某同学根据此实验测得的数据,计算硫酸铵化
肥的含氮量偏高(>21.2%),请分析实验装置中存在一个明显缺陷是: 。
[探究结论]
(5)用改进后的实验装置重新进行实验。
称取13.5 g硫酸铵化肥样品,测得实验前后乙装置增重3.40 g。该化肥 (填“是”或“不是”)一等品。
24.(12分)目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:ks*5u
|
2NaCl (熔融)====Cl2↑+ 2Na。现有如下转化关系(其他产物和水已略去):
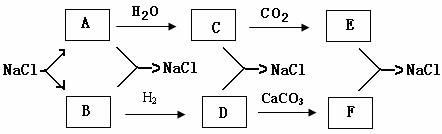
(1)写出A、D、F的化学式。
A ;D ;F ;
(2)写出下列化学方程式:
C+D→NaCl:________________________________________________________
E+F→NaCl:_________________________________________________________
2、产生标况下11.2L Cl2 ,则被氧化的HCl的物质的量为__________摩。
1、用双桥式表示电子转移的方向和数目。
23.(12分)(1)实验室里有已配制好的NaOH溶液,一瓶所贴标签为6mol·L-1,另一瓶所贴标签为12%(密度为1.12g·mL-1)。则12%的NaOH溶液的物质的量浓度为 。
(2)在50 mL NaNO3和Na2SO4的混合溶液中,c (Na+) = 1 mol/L,往其中加入50 mL BaCl2溶液恰好完全反应,得到2.33 g白色沉淀,则原混合溶液中c (NO3-)= 。
(3)实验室里常用KMnO4与浓盐酸反应制取少量氯气,其化学方程式为:
2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
22.(8分)按要求完成有关化学方程式:
⑴ 钠在空气中燃烧: 。
⑵ 氢氧化钠溶液吸收氯气: 。
⑶ 加热除去Na2CO3固体中混有的少量NaHCO3固体:
。
⑷ 实验室用NH4Cl 固体与熟石灰制取少量的NH3 气体:
。
21.(8分)在①CO2、②NO2、③CO、④Cl2、⑤HCI、⑥NH3气体中(用序号填空)
(1)有颜色的气体是 ;
(2)易溶于水,水溶液显碱性的是 ;
(3)导致煤气中毒的气体是 ;
(4)试管中充满某气体后倒立于盛水的水槽中,试管中立即充满液体;试管中原来所充的气体是 ;
20.下列物质既具有氧化性又有还原性的是( )
①SO2 ②CO2 ③ Fe2+ ④ HCl ⑤ H2O2
A.①②③ B.①③ C.①③⑤ D.①③④⑤
第Ⅱ卷(非选择题 共60分)
19.某二价金属的碳酸盐和碳酸氢盐的混合物跟足量的盐酸反应,消耗的H+和产生的CO2的物质的量之比为6︰5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为( )
A.1︰1 B. 1︰2 C.1︰3 D.1︰4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com