
题目列表(包括答案和解析)
21、(10分)⑴10g(2分)
⑵玻璃棒,500mL容量瓶,烧杯和玻璃棒,容量瓶,容量瓶,胶头滴管(每空1分)
⑶B(2分)
20、(14分)(1) 试剂: Na2CO3、 NaOH,HCl(每空1分)
(2)离子方程式:Ca2++CO32-=CaCO3↓;Mg2++2OH-=Mg(OH)2↓;
CO32-+2H+=CO2↑+H2O;OH-+H+=H2O(每空2分)
(3)HCl,,BaCl2 溶液(每空1分)
(4)蒸发结晶( 1分)
|
(1)实验室从化学试剂商店买回的硫酸试剂属于 (填:“纯净物”“混合物”)
(2)一瓶上述硫酸试剂的质量为 ,其中硫酸的物质的量为 ,
(3)上述硫酸试剂的物质的量的浓度为
21、(10分)配制500 mL 0.5 mol/L NaOH 溶液,试回答下列问题:
⑴需要称取NaOH固体的质量为 ;
⑵配制方法:设计五个操作步骤,请在横线上填上合适的仪器名称
①向盛有NaOH的烧杯中加入100 mL蒸馏水使其溶解,并冷却至室温。
②将NaOH溶液沿 注入 中。
③在烧杯中加入少量的蒸馏水,小心洗涤 2-3次并把每次的洗涤液都转移入 。
④继续往 中加蒸馏水至液面接近刻度线1-2cm。
⑤改用 滴加蒸馏水至刻度线,盖好摇匀。
⑶以下操作会使实际配制NaOH溶液的浓度偏低的有________
A.定容时俯视刻度线 B.溶解后的烧杯未经洗涤
C.称量用的烧杯不干燥 D.容量瓶中原来存有少量蒸馏水
20、(14分)某食盐溶液中含有Ca2+、Mg2+等杂质离子,现设计实验,采用常见的试剂,精制食盐溶液。回答下列问题:
⑴操作:依次向溶液中加入足量的____________溶液和足量______________溶液,过滤,向滤液中加入适量的_______________;
(2)有关反应的离子方程式____________________,_____________________, _______________________,________________________;
(3)检验提纯后的食盐溶液中是否含有SO42- 的方法是:取少量溶液置于试管中,向溶液中加入足量的 ,然后加入几滴 溶液,若产生白色沉淀说明有SO42- ;若不产生白色沉淀说明无SO42-。
(4)从食盐溶液中得到NaCl晶体的操作方法_______________。
19、(10分)有下列反应:
①Fe + CuSO4 = Cu + Fe SO4 ②CaO +H2O = Ca(OH) 2
③Ba(OH)2 + H2SO4= BaSO4↓ +2H2O ④Zn + 2HCl = ZnCl2 + H2↑
⑤2KClO3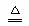 2KCl
+ O2↑
⑥CaCO3
2KCl
+ O2↑
⑥CaCO3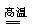 CaO
+ CO2↑
CaO
+ CO2↑
⑦2CO + O2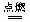 2CO2
⑧SO42-+ Ba2+ = BaSO4↓
2CO2
⑧SO42-+ Ba2+ = BaSO4↓
(1)既是分解反应又是氧化还原反应是_______________,既是化合反应又是氧化还原反应是_______________;
(2)反应①中,氧化剂是_______________,还原剂是_______________;
(3)反应③的离子反应方程式为_________________________________
(4)反应④的离子反应方程式为_________________________________
(5)写出一个符合⑧的化学反应方程式_________________________________
18、(5分)现提供以下分离或提纯物质的方法:①萃取;②过滤;③蒸发结晶;④分液;⑤蒸馏。下列各组混合物的分离或提纯应选用那种方法最合适,将所选方法的编号填入括号中: A.除去CaCl2溶液中悬浮的CaCO3粒子 ( )
B.提取碘水中的碘单质 ( )
C.分离酒精和水的混合物 ( )
D.分离水和四氯化碳的混合物 ( )
E.从氯化钠溶液中得到食盐晶体 ( )
17.钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O;下列说法正确的是( )
A.反应①、②中电子转移数目不相等 B.反应①中氧化剂是氧气和水
C.反应①②③均属于氧化还原反应 D.反应①中每1mol O2反应转移4mol电子
第II卷(非选择题,共49分)
16.从海水中可以提取溴,主要反应为:2Br-+Cl2=2Cl-+Br2,下列说法正确的是( )A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
15.下列说法中正确的是( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.乙醇和水的混合溶液可用分液漏斗进行分离
C.分液漏斗在使用之前要检查是否漏气
D.分液时,先将下层液体从分液漏斗下口放出,再将上层液体从上口倒出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com