
题目列表(包括答案和解析)
21.(8分)(1)(3分)K2Cr2O7
+ 14HCl ====
2KCl + 2CrCl3 + 3Cl2›+ 7H2O
====
2KCl + 2CrCl3 + 3Cl2›+ 7H2O
(2)(每空1分) Cl; K2Cr2O7 Cl2
(3)(2分) 134.4
26.已知反应:2Fe2+ + Br2 == 2Fe3+ + 2Br- ; 2Br- + Cl2 == Br2 + 2Cl-回答下列问题
(1)FeCl2溶液中通入Cl2是否能发生反应 (填“能”或“不能”),若能发生反应,请写出该反应的离子方程式 。
(2)向2L 0.5mol/L的FeBr2溶液中通入标况下的Cl2 22.4L,则被氧化的Br-的物质的量为 mol,写出该反应总的离子方程式:
(3)写出向FeBr2溶液中通入过量的Cl2的离子方程式:
25.(6分)某有色溶液中,可能大量存在Ag+、H+、Cu2+、CO32-、OH-、Cl-,你认为一定有的离子是 ,一定没有的离子是 ,还需进一步确认的离子
是 。
24.(10分)有A、B、C、D四种可溶性盐,它们的阳离子可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能是NO3-、Cl-、SO42-、CO32-中的某一种。
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有A盐溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,则B盐溶液有沉淀产生,C盐溶液有无色无味气体产生。根据(1)(2)实验事实回答下列问题。
(1)A、B、C、D的化学式分别为:
A: ,B: ,C: ,D:
(2)写出C盐和盐酸反应的离子方程式:
写出A盐和D盐反应的离子方程式:
写出B盐和D盐反应的化学方程式:
23.草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的 CO32- 、 SO42- 和 Cl- 。
(1)从草木灰中提取钾盐的实验操作顺序如下:
①称取样品,②溶解沉降,③ ,④ ,⑤冷却结晶。
(2)用托盘天平称量样品时,若某同学把样品放在右盘,砝码放在左盘,当天平平衡时读为24.4g(1克以下用游码) ,则样品的实际质量为 。
(3)将制得的少量晶体放入试管,加入蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有 生成,证明溶液中有碳酸根离子。
②在第二支试管里加入足量 后,再加入 ,可观察到有白色沉淀生成,证明溶液中有硫酸根离子。(写物质名称)
③在第三支试管里加适量的硝酸银溶液,观察到有沉淀产生,由此证明溶液中一定含Cl-。你认为该结论是否严密? (填“严密”或“不严密”)为什么?
22.(4分)已知PbSO4沉淀既不溶于水也不溶于酸,但能溶于CH3COONH4溶液,向PbSO4沉淀加入CH3COONH4溶液,沉淀溶解得到无色溶液,发生的反应为:
PbSO4 + 2CH3COONH4 == (CH3COO)2Pb + (NH4)2SO4 请写出该反应的离子方程式
________________________________________________________________________
21.(8分)在 K2Cr2O7 + 14HCl ====
2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
====
2KCl + 2CrCl3 + 3Cl2›+ 7H2O反应中。
(1)用双线桥表示该氧化还原反应
(2) 元素被氧化, 是氧化剂,氧化产物是
(3)此反应若转移了12mol的电子,则生成氯气 L(标准状况)
20.t℃时,相对分子质量为A的某物质的饱和溶液,其物质的量浓度为Bmol·L-1,密度为ρg·cm-3,则该物质在t℃时溶解度为
A.  g
B.
g
B.  g
g
C. 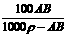 g
D.
g
D.  g
g
Ⅱ卷 非选择题(共40分+10分)
19.10月6日,瑞典皇家科学院宣布,美国科学家理查德·赫克和日本科学家根岸英一
及铃木章共同获得今年的诺贝尔化学奖。赫克、根岸英一和铃木章通过实验发现,碳原
子会和钯原子连接在一起,进行一系列化学反应。这一技术让化学家们能够精确有效地
制造他们需要的复杂化合物。氯气(Cl2)和氧气(O2)都是活泼的非金属单质,在一定条件
下它们都能跟甲烷(CH4)反应。已知O2和CH4充分反应后的生成物是CO2和H2O,由此推断
Cl2和CH4充分反应后的生成物是
A.CCl4和HCl B.CCl4和H2 C.CH2C12和H2 D.C和HCl
18.下列化学反应,氧化剂和还原剂的物质的量之比是1:2的是
A.Cu + 2H2SO4 == CuSO4 + SO2↑+ 2H2O B.Cu + 4HNO3 == Cu(NO3)2 + 2NO2↑+ 2H2O
C.CaCO3 + 2HCl==CaCl2 + CO2↑+ H2O D.3NO2 + H2O == 2HNO3 + NO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com