
题目列表(包括答案和解析)
29.(16分)我国拥有丰富的海洋资源,海水制盐历史悠久,早在5000年前的仰韶文化时期,先人就利用海水煮盐。为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
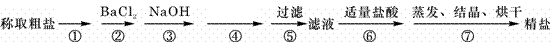
(1)第①步操作的名称是 ,第②步判断BaCl2已过量的方法是
 。
。
(2)第④步加入试剂的化学式为 ,相关的离子方程式是
。
(3)第⑤步操作所需玻璃仪器的名称是 。
(4)若第⑤步、第⑥步顺序颠倒,将对实验结果产生影响,其原因是
。
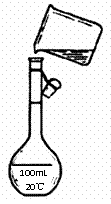
(5)为测定精盐纯度,需配制250
mL 0.2 mol/L NaCl(精盐)溶液, 右图是该同学
右图是该同学
转移溶液的示意图,图中的错误有
。
(6)溶液配制过程中的下列操作会导致浓度偏低的是 。
A.未洗涤烧杯和玻璃棒。 B.移液时有少量溶液溅到刻线以上的内壁上。
C.定容时,水加多后用胶头滴管吸出。 D.定容后经上下颠倒摇匀,静置后液面低于刻度线。
五校协作体2010-2011学年度上学期期中考试
高一化学试题
1-15每题2分BDCDB DAAAA DDDCD
16-25每题3分 DCADC CBDDA
27.(8分)有一包白色固体粉末,其中可能含有NaCl、BaCl2、Cu(NO3)2、Na2CO3中的。一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)写出原白色粉末中一定含有的物质的化学式
(2)写出原白色粉末中一定不含的物质的电离方程式
(3)写出下列各步变化的离子方程式:
②
④
26.(9分)氧化还原反应中实际包含氧化和还原两个过程。下面是一个还原过程的反应式:
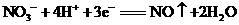 ,
,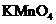 、
、 、
、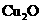 、
、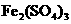
四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质甲为 (填名称)。
(2)写出并配平该氧化还原反应的离子方程式:____________________。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是______________mol。
(4)此反应中参加反应的硝酸与被还原的硝酸物质的量之比为 ______
25.已知N2、CO2的混合气体的质量共9.6克,标准状况下,体积为6.72L,则该混合气体中N2和CO2的体积比为
A.3:1 B.1:3 C.2:3 D.1:2
Ⅱ卷 非选择题(40分)
24.下列离子方程式正确的是
A.碳酸钙溶于稀盐酸中: CO32-+2H+=CO2↑+H2O
B.钠与水反应: Na+2H2O=Na++2OH-+H2↑
C.碳酸氢钠溶液中加入过量澄清石灰水:2HCO3-+Ca2+ +2OH-=CO32-+CaCO3↓+2H2O
D.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
23.将10mL、2mol·L-1Na2CO3溶液逐滴加入到80 mL、0.5mol·L-1MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4 B.3
C.2 D.1
22.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
21.用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.00g.则此铅氧化物的化学式是:
A.PbO B.Pb2O3 C.Pb3O4 D.PbO2
20.下列关于铝的说法中不正确的是
A.铝是地壳中含量最多的金属元素
B.铝是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C.铝箔在空气中受热可以熔化,且发生剧烈的燃烧
D.铝箔在空气中受热可以熔化,但由于氧化膜存在,铝熔化并不滴落
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com