
题目列表(包括答案和解析)
21.(7分)已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关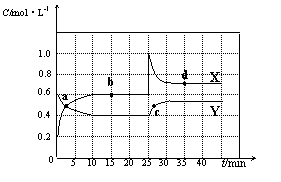 系如下图所示。
系如下图所示。
(1)图中共有两条曲线X和Y,其中表示NO2浓度 随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。
②反应2NO2(g) 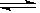 N2O4(g)在b点平衡常数的表达式是K(b)=
。
N2O4(g)在b点平衡常数的表达式是K(b)=
。
③反应2NO2(g) 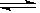 N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
K(d) K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25 min时采取的措施是 (填序号)。
A.加入催化剂 B.缩小容器体积
C.加入一定量的NO2 D.加入一定量的N2O4
②若在35 min时,保持温度不变,快速缩小容器的体积至1 L,气体的颜色变化过程是
20.(10分)在常温下,下列五种溶液:①0.1 mol/L NH4Cl ②0.1 mol/L CH3COONH4 ③ 0.1 mol/L NH4HSO4 ④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液 ⑤0.1 mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是 (用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;由水电离出c(H+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1 mol/L;NH3·H2O和 离子的物质的量浓度之和为0.2 mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度____(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
18、已知0.1 mol/L的醋酸溶液中存在电离平衡: CH3COOH CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
A.加少量CH3COONH4固体 B.降低温度
C.加少量NaOH固体 D.升高温度
Ⅱ卷
17、右图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述正确的是
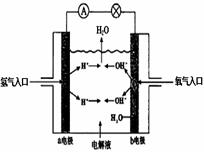 A.a电极是阴极
A.a电极是阴极
B.b电极的电极反应为:4OH--4 e-=2H2O +
O2
C.电池工作时,电子由正极通过外电路流向负极
D.氢氧燃料电池是一种具有应用前景的绿色电
源
16、在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的是
A. 滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- B. pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- C. 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ D. 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+
15、 已知某可逆反应:mA(g)+nB(g)
已知某可逆反应:mA(g)+nB(g) 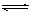 pC(g) △H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g) △H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
A.T1<T2,p1>p2,m+n>p,△H>0
B.T1>T2,p1<p2,m+n>p,△H>0
C.T1>T2,p1<p2,m+n<p,△H<0
D.T1>T2,p1>p2,m+n>p,△H<0
14、下列水解化学方程式或水解离子方程式正确的是:
A.CH3COO-
+ H2O CH3COOH + OH-
B.NH4+ + H2O
CH3COOH + OH-
B.NH4+ + H2O NH4OH + H+
NH4OH + H+
C.CH3COOH + NaOH CH3COONa + H2O D.NaCl + H2O
CH3COONa + H2O D.NaCl + H2O NaOH + HCl
NaOH + HCl
13、常温下,下列离子能使纯水中的H+离子数目增加的是
A.S2- B.CO32- C.NH4+ D.Br-
12、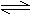 可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
11、下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 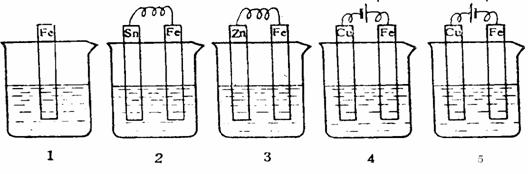
A. 4>2>1>3>5 B. 2>1>5>3>4
C. 5>4>2>3>1 D. 3>5>2>4>1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com