
题目列表(包括答案和解析)
8.下列离子方程式,书写正确的是
A.碳酸钙和盐酸反应 CO32-+2H+=H20+CO2↑
B.向氢氧化钡溶液中加硫酸溶液 Ba2++ SO42-=BaSO4
C.向硝酸银溶液中加盐酸 Ag++C1-=AgCl↓
D.向稀盐酸溶液中加铁粉 3Fe+6H+=2Fe3++3H2↑
7.下列的分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙 B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘 D.用淘洗的方法从沙里淘金
6.胶体粒子直径范围在
A.小于1nm B. 1nm-100 nm C. 大于100nm之间 D. 等于100nm
5、溶液、胶体和浊液的本质区别是
A.稳定性 B.外现待征
C.分散质颗粒大小 D.丁达尔反应
4.下列叙述中,正确的是
A.物质的量就是物质的质量
B.物质的量是指物质的数量
C.物质的量是国际单位制中的一个物理量
D.物质的量是描述多少的单位
3.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8 g的NH4+ 离子中含有的电子数为0.1NA
C.常温常压下,11.2 L氧气所含的原子数为NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.1 NA
2.下列说法正确的是
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价降低的反应是氧化反应
D.氧化反应和还原反应是同时发生的
1、下列叙述中正确的是
A.1 molH20的质量是18g·mol-1[来源:高&考%资(源#网]
B.硫酸根离子的摩尔质量是96 g
C.C02的摩尔质量是44 g·mol-1
D.HCl的相对分子质量是36.5 mol-1
31、纯碱是工业生产和日常生活中的重要物质。某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究。请填空:
方案一:纯碱样品 测定剩余固体质量
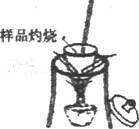
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图)。坩埚中发生反应的化学方程式为:
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热一冷却一称量”操作多次,其目的是
。
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图)。坩埚中发生反应的化学方程式为:
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热一冷却一称量”操作多次,其目的是
。
 方案二:纯碱样品溶液
方案二:纯碱样品溶液 测定沉淀质量
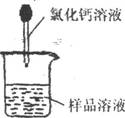
(3)称取m 1g样品,置于小烧杯中,加水溶解。向小烧杯中滴加足量氯化钙溶液(如下图),沉淀完全后,讲混和物进行的后续两步操作分别是 和
。
(4)沉淀经干燥后称量为m 2g,则该样品中碳酸钠的质量分数为
(5)如果用过量的氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”)。所涉及的离子反应方程式为:
。
测定沉淀质量
(3)称取m 1g样品,置于小烧杯中,加水溶解。向小烧杯中滴加足量氯化钙溶液(如下图),沉淀完全后,讲混和物进行的后续两步操作分别是 和
。
(4)沉淀经干燥后称量为m 2g,则该样品中碳酸钠的质量分数为
(5)如果用过量的氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”)。所涉及的离子反应方程式为:
。
方案三:纯碱样品 测定生成CO2的质量
测定生成CO2的质量
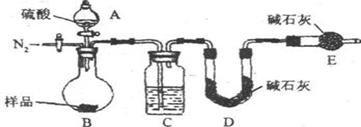
(6)本实验采用上图装置,实验中进行的第一步操作名称是: ,
C中盛放的物质是 (7)反应前后都要通入N2,反应后通入N2的目的是 。
(8)要确定纯碱样品的纯度,除了样品的质量外,实验还需要获取的数据是:
。
33、将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com