
题目列表(包括答案和解析)
1、下列实验操作中错误的是( )
A.在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌
B.用药匙或者纸槽把粉末状药品送入试管的底部
C.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 D.如果没有试管夹,可以临时手持试管给固体或液体加热
30.(1)H2SO4==2H++SO42- (2)2 (4)4.48
(3)分别取少量试液与试管中,分别加入紫色石蕊试液和盐酸酸化的氯化钡溶液,如果溶液变红,说明有H+,有白色沉淀生成,说明有SO42-
30.(14) 现有200 mL 1mol/L H2SO4溶液,回答下列问题:
(1)写出H2SO4的电离方程式
(2)该H2SO4溶液中H+的物质的量浓度是
(3)请设计一个实验方案,证明此溶液中含有H+和SO42-离子:
(4)用此H2SO4溶液和足量金属Zn反应,可以得到标准状况下气体多少升?(4分)
29略
29.(30分)已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。请回答下列问题:
⑴写出元素X、Y、Z的元素符号:X: ,Y: ,Z 。
⑵写出A、B、C、D的化学式:A ,B ,C ,D 。
⑶画出Y原子的结构示意图 ;写出③中反应的化学方程式 。
⑷写出④中反应的化学方程式 。
实验室通过反应④制得元素Y的单质后,如何将产物分离并分别获得纯净物?写出实验步骤:
(5)制得元素Y的单质,若收集到标准状况下6.72LY单质气体,至少需要多少克化合物D?同时生成氯化物的物质的量为多少mol?(用涉及到的化学式写出计算步骤)
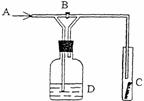
28.下图是一种试验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
A.浓H2SO4 B.饱和NaBr溶液 C.浓NaOH溶液 D.H2O

二。填空题
27.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法不正确的是 ( )
A、KClO3在反应中得到电子 B、ClO2是还原产物
C、H2C2O4在反应中被氧化 D、1 molKClO3参加反应有2mol电子转移
26、元素R的质量数为A,Rn一的核外电子数为x,则WgRn-所含中子的物质的量为
A.(A-x+n)mol B.(A-x-n)mol
C. mol D.
mol D.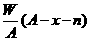 mol
mol
25.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列说法正确的是
A.原子半径:A > B > D > C B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.单质的还原性:A > B > D > C
24.配制100mL1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是
A.容量瓶使用前有少量蒸馏水 B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.在转移过程中有溶液撒在外面 D.定容时俯视确定凹液面与刻度线相切
23.关于配制NaCl溶液的叙述不正确的是
A.托盘天平称取58.5g食盐,加1升水配制成溶液,NaCl溶液浓度为1mol·L-1
B.转移时,要用玻璃棒引流
C.溶解食盐的烧杯要洗涤2-3次并将洗涤液转移到容量瓶中
D.搅拌可加速溶解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com