
题目列表(包括答案和解析)
18.⑴按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
②硫酸氢钠溶液中滴加纯碱溶液
⑵写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的两个化学方程式
①
 ②
②
17.在K2Cr207+14HCl=2KCl+2CrCl3+3Cl2↑+7H20反应中, 是氧化剂; 是还原剂;
元素被氧化;
元素被还原; 是氧化产物; 是还原产物; K2Cr207参与反应电子转移的总数为
.
K2Cr207参与反应电子转移的总数为
.
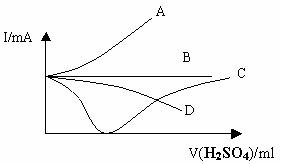
16. 向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )
15. 在三种正盐混合而成的溶液中,含有0.2mol Na+,0.25mol Mg2+,0.4mol Cl-,则SO42-为( )
A. 0.11 mol B. 0.3 mol C. 0.5 mol D. 0.15 mol
14、在100克浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加水的体积为(提示:硫酸溶液浓度越大,其密度越大)( )
A、大于100mL B、等于100mL
C、小于100mL D、等于100/ρmL
13.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 ,下列操作顺序不合理的是 ( )
A.③②①⑤④ B.③①②⑤④ C.②③①⑤④ D.①③②④⑤
12.下列实验操作中有错误的是 ( )
A.萃取分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出
D.鉴别SO42-时的操作顺序是先加入BaCl2溶液,再加稀盐酸
11.在常温下,发生下列几种反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-
根据上述反应,判断下列结论中错误的是( )
A.溶液中可发生:Z2+2A2+=2A3++2Z- B.Z2在①、③反应中为还原剂
C.氧化性强弱的顺序为:XO4->Z2>B2>A3+ D.X2十是XO4-的还原产物
10.下列各组中的离子,能在溶液中大量共存,且溶液呈无色的是( )
A.Na+、Mg2+、NO3-、OH- B.Na+、Cu2+、Cl-、SO42-
C.Na+、H+、CO32-、Cl- D.Na+、K+、NO3-、Br-
9.下列离子方程式书写正确的是( )
A.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
D.NaHCO3溶液中加NaHSO4溶液:HCO3-+H+=CO2↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com