
题目列表(包括答案和解析)
5.钾和钠的性质相似,下列说法中能较好地解释这个事实的是 ( )
A.最外层电子数相同 B.都是金属元素
C.原子半径相差不大 D.最高化合价相同
4.下列物质中,含有共价键的单质是( )
A.H2O B.MgCl2 C.NaOH D.H2
3.下列具有相同电子层数的一组原子是 ( )
A.H、Li B.F、Cl C.Na、Al D.O、S
2.据报道,某些建筑材料会产生放射性同位素氡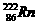 ,从而对人体产生伤害,该同位素原子的质子数是( )
,从而对人体产生伤害,该同位素原子的质子数是( )
A.136 B.50 C.86 D.222
1.提出元素周期律并绘制了第一个元素周期表的科学家是( )
A.戴维 B.阿伏加德罗 C.门捷列夫 D.道尔顿
31.(6分)用KMnO4氧化密度为1.19g/cm3,溶液质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
现有31.8g KMnO4与足量的浓盐酸反应完全反应后
(1)有多少克HCl被氧化?
(2)在标准状态下生成的Cl2是多少升?
衡阳市八中2010年下期期中考试
30.实验室欲用NaOH固体配制1.0mol/L的NaOH溶液480mL:
(1)配制时,必须使用的玻璃仪器有 。
(2)要完成本实验该同学应称出NaOH___ __g。
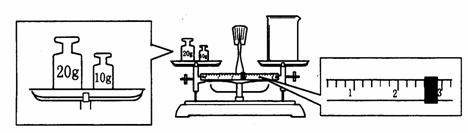 (3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图. 烧杯的实际质量为
g
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图. 烧杯的实际质量为
g
(4)使用容量瓶前必须进行的一步操作是 。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是 。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
29.(8分)已知0.1 mol/L的NaHSO4溶液中H+的物质的量浓度为0.1mo1/L,请回答下列问题:
(1)写出NaHSO4 在水溶液中电离的方程式 。
(2)NaHSO4属于(填“酸”“碱”或“盐”) 。
(3)若将NaHSO4与Ba (OH)2在溶液中按物质的量之比为2:1混合,则反应的离子方程式是 。
(4)若将NaHSO4溶液逐滴滴入Fe(OH)3胶体溶液可观察到的现象是 。
28.(8分)在MnO2 + 4HCl = MnC12 + C12↑+2H2O的反应中:
① 是氧化剂
② 发生氧化反应的物质是 。
③ 在参加反应的盐酸中.起还原剂作用的HC1与起酸性作用的HC1的质量比为 。
④当1mol的MnO2完全反应时电子转移的的总数为 mol
27.(10分)现有m g某气体,它由四原子分子构成,它的摩尔质量为M g·mol-1,则:
(1)该气体的物质的量为 mol.
(2)该气体中所含的原子总数为 个.
(3)该气体在标准状况下的体积为 L.
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为 .
(5)该气体溶于1L水后形成密度为ρ的溶液,其溶质的物质的量浓度 mol·L-1.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com