
题目列表(包括答案和解析)
1.在食品加工或餐饮业中使用量特别要注意严加控制的物质是( )
A.氯化钠 B.谷氨酸钠(味精) C.碳酸氢钠 D.亚硝酸钠
思路解析:几种钠盐中,氯化钠和碳酸氢钠是学生非常熟悉的,谷氨酸钠的化学名称学生虽然不熟悉,但后面所附的俗名却是学生生活中常见的物质,只有亚硝酸钠学生可能了解不多,可用排除的方法来解答。
答案:D
4.氢氧化铝与其他的氢氧化物不同,既能与酸反应生成盐和水,又能与碱反应生成盐和水,试用离子方程式表示它与酸和碱反应的原理。
思路解析:教材上既有氢氧化铝与盐酸和氢氧化钠反应的实验又有化学方程式,我们只需将化学方程式改写成离子方程式即可。
答案:Al(OH)3+3H+====Al3++3H2O;Al(OH)3+OH-====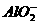 +2H2O。
+2H2O。
10分钟训练(强化类训练,可用于课中)
3.氢氧化亚铁与氢氧化铁都是铁的氢氧化物,它们有什么异同?
思路解析:从它们的物理性质与化学性质的不同方面来进行比较,同时对它们之间的转化关系也应该清楚。
答案:列表将它们的性质与变化比较如下:
|
|
氢氧化铁 |
氢氧化亚铁 |
|
物理性质 |
红褐色,难溶于水 |
白色,难溶于水 |
|
化学性质 |
具有碱的通性 |
具有碱的通性,易被氧化为氢氧化铁 |
|
联系 |
4Fe(OH)2+O2+2H2O====4Fe(OH)3(白色迅速变为灰色、绿色,最终成为红褐色) |
2.根据下图填写表格(金属氧化物溶于盐酸):

完成下表:
|
金属氧化物 |
颜色 |
化学方程式 |
离子方程式 |
|
|
固体 |
溶液 |
|||
|
MgO |
|
|
|
|
|
Fe2O3 |
|
|
|
|
|
CuO |
|
|
|
|
思路解析:几种金属氧化物固体和溶液的颜色都可以通过观察得出,而化学方程式的书写则可根据金属氧化物与酸反应的规律--生成盐和水来完成,离子方程式则将盐酸和金属的氯化物都拆开就可以了。
答案:见下表。
|
金属氧化物 |
颜色 |
化学方程式 |
离子方程式 |
|
|
固体 |
溶液 |
|||
|
MgO |
白色 |
无色 |
MgO+2HCl====MgCl2+H2O |
MgO+2H+====Mg2++H2O |
|
Fe2O3 |
暗红色 |
浅黄色 |
Fe2O3+6HCl====3FeCl3+3H2O |
Fe2O3+6H+====2Fe3++3H2O |
|
CuO |
黑色 |
蓝色 |
CuO+2HCl====CuCl2+H2O |
CuO+2H+====Cu2++H2O |
1.对下列物质按不同的分类方法进行分类。
Al2O3、Al、AlCl3、Al(OH)3、Fe2O3、FeO、Fe3O4、CaO、CuO、Fe、Cu、Ca、FeSO4、Fe2(SO4)3、Fe(OH)2、Fe(OH)3、Ca(OH)2、Cu(OH)2、CuSO4、CuCl2
思路解析:物质的分类可以按不同的分类标准进行分类。
答案:按物质的基本类型进行分类:
|
类别 |
单质 |
氧化物 |
碱 |
盐 |
|
物质 |
Al、Fe、Cu、Ca |
Al2O3、Fe2O3、FeO、Fe3O4、CaO、CuO |
Al(OH)3、Fe(OH)2、Fe(OH)3、Ca(OH)2、Cu(OH)2 |
AlCl3、Fe2(SO4)3、FeSO4、CuSO4、CuCl2 |
按元素也可以分成不同类型:
|
元素 |
含铝元素的物质 |
含铁元素的物质 |
含钙元素的物质 |
含铜元素的物质 |
|
单质 |
Al |
Fe |
Ca |
Cu |
|
氧化物 |
Al2O3 |
Fe2O3、FeO、Fe3O4 |
CaO |
CuO |
|
碱 |
Al(OH)3 |
Fe(OH)2、Fe(OH)3 |
Ca(OH)2 |
Cu(OH)2 |
|
盐 |
AlCl3 |
Fe2(SO4)3、FeSO4 |
- |
CuCl2、CuSO4 |
还可以分为诸如硫酸盐(Fe2(SO4)3、FeSO4、CuSO4)等类别。
16.某化学课外小组用海带为原料抽取了少量碘水。现以四氯化碳从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分为以下几步:
①把盛有溶液的分液漏斗放在铁架台的铁圈中;
②把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
③检验分液漏斗活塞和上口的玻璃塞是否漏液;
④倒转分液漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
⑤旋开活塞,用烧杯接收溶液;
⑥从分液漏斗上口倒出上层水溶液;
⑦将漏斗上口的玻璃塞打开或使活塞上的凹槽或小孔对准漏斗口上的小孔;
⑧静置分层。
就此实验,完成下列填空:
(1)正确操作的顺序是(用上述操作的编号填写):_______________→_______________→______________→①→⑦→_____________→⑤→⑥。
(2)上述⑤步骤的操作中应注意______________________________;上述⑦步骤的操作目的是_____________________________________________________________________________。
(3)选用四氯化碳萃取碘的理由是________________________________________________。
思路解析:本题的立意是综合考查萃取和分液的原理及基本操作。其中涉及到实验能力的考查,解题的关键是掌握萃取的原理和萃取、分液的基本操作。
答案:(1)③ ② ④ ⑧
(2)使漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不要让上层液体流出 使漏斗内外空气相通,以保证液体能顺利流出。
(3)四氯化碳与水既不互溶也不反应;碘在四氯化碳中的溶解度比在水中的溶解度要大得多。
15.如下图所示,①、②、③、④分别是几种常用漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去)。请根据实际使用操作时上述漏斗的范围和它们的形状,指出A、B、C、D分别与①、②、③、④中哪一种最为匹配。
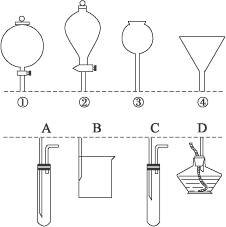
A与_______________;B与_______________;C与_______________;D与______________。
思路解析:本题主要考查漏斗、分液漏斗、长颈漏斗的识别及各类漏斗的作用。A属制气装置,由图示可知,它可利用长颈漏斗添加溶液制气;B属分液或过滤或向烧杯中添加液体试剂的装置,②、④可与之连接;C属于制气装置,为防止气体从漏斗中逸出,应选用分液漏斗①;D为向酒精灯中添加酒精的装置,一般选用普通漏斗即可。
答案:③ ②、④ ① ④
14.请你说出过滤的注意事项,并尽可能记忆下来。
思路解析:过滤的注意事项可以简称为“一贴二低三靠”,即滤纸紧贴漏斗;滤纸低于漏斗口、溶液低于滤纸上缘;烧杯紧靠玻璃棒、玻璃棒紧靠滤纸三层重叠部位、漏斗下口紧靠收集溶液的烧杯内壁。
答案:过滤的注意事项:滤纸紧贴漏斗;滤纸低于漏斗口、溶液低于滤纸上缘;倾倒溶液的烧杯紧靠玻璃棒、玻璃棒紧靠滤纸三层重叠部位、漏斗下口紧靠收集溶液的烧杯内壁
13.有人归纳药剂取用有“三不”,你知道“三不”的含义吗?
思路解析:从化学试剂的特征来看,很多化学试剂是有毒、有腐蚀性的,所以我们为了安全,不能贸然直接用手接触药品、不要把鼻孔凑到瓶口闻气味,尤其不得品尝药品的味道。
答案:不直接用手接触试剂、不要把鼻孔凑到瓶口闻气味、不得品尝试剂的味道。
12.(2010江苏高考,4)以下实验装置一般不用于分离物质的是( )
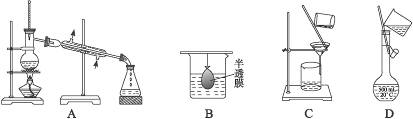
思路解析:由所给图示知,A蒸馏装置可分离沸点不同的液体;B渗析装置可分离提纯胶体与溶液;C过滤装置分离固体与液体;D容量瓶只能用于溶液配制,不能用于分离物质。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com