
题目列表(包括答案和解析)
25.某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。
⑶ 假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
24.硫通常是一种淡黄色晶体,它的蒸气有橙色、无色、红棕色三种,它们都是硫的单质,但是每个分子中硫原子的个数不同,可用SX表示,对三种蒸气测定的结果是:
(1)橙色蒸气的密度折算成标准状况后是11.34克/升,它的分子式为:
(2)红棕色蒸气的质量是相同状况下同体积空气的6.62倍,则它的分子式为:
(3)无色蒸气的密度是同状况下氢气密度的64倍,则它的分子式为: 。
22.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
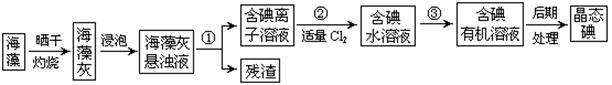
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;
(2)提取碘的过程中,可选择的有机试剂是 。
A.酒精 B.四氯化碳 C.苯
(3)实验操作③中,实验室已有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是 。
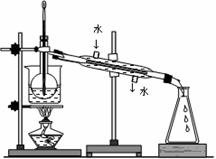 (4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,
指出右面实验装置图中的错误之处:
① ;
② ;
③ 。
(5)进行上述蒸馏操作时,使用水浴加热的原因是:
,
最后晶态碘在 里聚集(填仪器名称)。
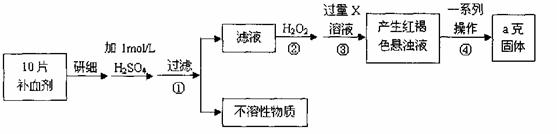 23.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
23.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1))证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硝酸
③滴定到终点时(恰好完全反应)的颜色为 色。k*s5u
21.下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦Fe ⑧金刚石 ⑨Cl2 ⑩澄清石灰水 ⑪NaOH 属于强电解质的有 ;属于弱电解质的有: 。(填序号)
20.向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是
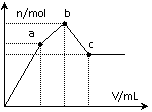 A.a点对应的沉淀只有BaSO4
B.c点溶液呈碱性
A.a点对应的沉淀只有BaSO4
B.c点溶液呈碱性
C.b点发生反应的离子方程式是:
Al3++2SO42-+2Ba2++3OH- == Al(OH)3↓+2BaSO4↓
D.c点加入Ba(OH)2溶液的体积为200 mL
19.某K2CO3固体样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种。现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质判断完全正确的是
A.肯定有KNO3 B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
18.铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2  2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。
Pb+CO2。
下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS冶炼成Pb理论上至少需要6g碳
17.下列物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3
A.③④ B.①②③④ C.①③④ D.全部
16.在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是k*s5u
A. 不溶物一定是Cu B. 不溶物一定含铜,但不一定含铁
C. 不溶物一定是Fe D. 溶液中一定含有Fe2+,但不一定含有Cu2+
15.某溶液中只含有Na+, Al3+, Cl-,SO42-四种离子,已知Na+, Al3+, Cl-的个数比为3:2:1。则溶液中Al3+与SO42-离子的个数比为
A.1:2 B.1:4 C.3:4 D.3:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com