
题目列表(包括答案和解析)
7.下列反应的离子方程式正确的是( )
A.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
6.下列类型的反应,一定发生电子转移的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
5.下列各组离子反应可用H++OH-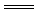 H2O表示的是( )
H2O表示的是( )
A.氢氧化钡和硫酸 B.氢氧化铁和盐酸
C.硝酸和氢氧化钠 D.碳酸氢钠和氢氧化钠
4.下列关于钠的叙述中,不正确的是( )
A.钠燃烧时发出黄色的火焰,生成过氧化钠
B.钠应保存在煤油中
C.钠有很强的还原性
D.金属钠着火时,可以用水灭火
3.下列物质中,能够导电的电解质是( )
A.Cu丝 B.熔融的MgCl2 C.NaCl溶液 D.蔗糖
2.下列电离方程式错误的是( )
A.Ba(OH)2
 Ba2+
+2OH- B.NaHSO4
Ba2+
+2OH- B.NaHSO4
 Na+
+H+ +SO42-
Na+
+H+ +SO42-
C.MgCl2
 Mg2+
+2Cl-
D.NaHCO3
Mg2+
+2Cl-
D.NaHCO3
 Na+
+H+ +CO32-
Na+
+H+ +CO32-
1.下列说法正确的是( )
A.可用丁达尔现象区分溶液与胶体
B.生石灰与水混合的过程只发生物理变化
C.胶体是一种纯净物
D.CuSO4·5H2O是一种混合物
24.(8分)向铜片中加入某浓度的硫酸120 mL,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500 mL,再加入足量锌粉,使之充分反应,收集到2.24 L(标准状况)气体,过滤残留固体,干燥后称量,质量减轻了7.5g,求原硫酸的物质的量浓度。
23、某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出):
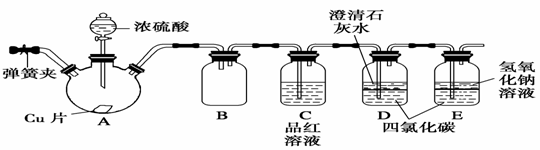

请回答下列问题:
(1)D、E两容器中CCl4的作用是 。
(2)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,底部有白色沉淀生成,你认为该沉淀物是 ,分析可能的原因是 。
(3)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D容器中澄清石灰水出现浑浊或沉淀。你的猜想是 。
设计实验验证你的猜想 。
4)实验结束后,为了减少环境污染,将各容器中的SO2除尽,可采取的操作是 。
22.(8分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量关系如图所示:
(1)混合物中AlCl3的质量为 ,混合物中MgCl2的质量为 .
(2)C点表示盐酸的体积是 .

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com