
题目列表(包括答案和解析)
0.39g y
则有:78g:1mol=0.39g:y
y=0.005mol
 所以:V(NaOH)=
所以:V(NaOH)= =0.0025L=2.5mL
=0.0025L=2.5mL
所以这两步消耗氢氧化钠总的体积为:15mL+2.5mL=17.5mL。
答:消耗氢氧化钠7.5mL或者17.5mL时能得到0.39g氢氧化铝沉淀。
2、(5分)第二种情况是:铝离子全部沉淀完全,然后过量的氢氧化钠再溶解一部分氢氧化钠;根据题中图所示,当铝离子完全沉淀时,消耗氢氧化钠的体积为:15mL,此时生成氢氧化铝的质量为0.78g,要想得到0.39g氢氧化铝,还必须再溶解0.39g氢氧化铝。所以有:
设:溶解0.39g氢氧化铝需要氢氧化钠的物质的量为y
Al(OH)3 + OH- = AlO2- + 2H2O
78g 1mol
30.(13分)向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如下图所示,试回答下列问题:
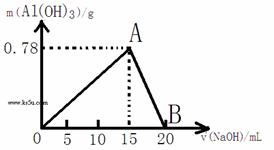
(1)上述两步反应用总的离子方程式可表示为: ;(3分)
(2)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为 。
(写出计算过程)(10分)
 30题答案:(1)Al3++4OH-=AlO2-+2H2O
30题答案:(1)Al3++4OH-=AlO2-+2H2O
(2)7.5mL或17.5mL
解:分两种情况:1、(5分)铝离子和氢氧化钠一步反应生成0.39g氢氧化铝,设需要氢氧化钠的物质的量为x,则有:
Al3+ + 3OH- = Al(OH)3↓
1mol 3mol 78g
X 0.39g
3mol:78g=x:0.39g
解:x=0.015mol
所以:V(NaOH)= =0.0075L=7.5mL
=0.0075L=7.5mL
29.(12分)Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)
 (1)则锥形瓶A中应加入的药品为________________________。(2分)
(1)则锥形瓶A中应加入的药品为________________________。(2分)
(2)锥形瓶B中应加入的药品为__________________________。(2分)
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2的后续操作步骤。
_____________________________________________________________。(4分)
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:
;(4分)
28.(10分)已知有以下物质相互转化
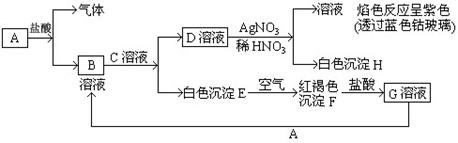
试回答:(1)写出B的化学式 D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN鉴别G溶液的离子方程式 ___ _ ;向G溶液加入A的有关离子反应方程式 。
27.(6分)某无色透明溶液,投入金属铝可放出H2。现有下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
(1)当生成Al3+时,可存在的离子有 ;(3分)
(2)当生成AlO2-时,可存在的离子有 。(3分)
26.(9分)
(1)除去NaHCO3溶液中的少量Na2CO3,方法是: ;
离子方程式为: 。(3分)
(2)除去铁粉中混有的铝粉,所用的试剂为: ;
离子方程式为: ;(3分)
(3)实验室制取氢氧化铝,所用的试剂为: ;
离子方程式为: ;(3分)
25.在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
化学试卷第II卷(共50分)
24. 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是
A.Mg2+、Al3+、Fe2+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.只有Mg2+、Al3+
23.取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为A
A.1:1 B.2:3 C.3:2 D.1:6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com