
题目列表(包括答案和解析)
20.(共10分)
某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成。请完成对该白色粉末成分的探究(可供选用的实验仪器及试剂如下)。

(1)提出合理假设
假设1:该白色粉末成分为碳酸钠;
假设2:该白色粉末成分为亚硫酸钠;
假设3: 。
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成,其最佳连接顺序是:a- (每组选用仪器和试剂限用一次)。
(3)根据(2)的连接顺序进行实验,填写相应现象。
|
假设方案编号 |
相应现象 |
|
假设1 |
|
|
假设2 |
|
|
假设3 |
|
19.(共10分)
下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
 (1)该浓盐酸中HCl的物质的量浓度为
。
(1)该浓盐酸中HCl的物质的量浓度为
。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________(填编号)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.40 mol/L的稀盐酸。
①该学生需要量取 mL(精确到小数点后一位)上述浓盐酸进行配制。
②现有a.10 mL量筒;b. 25 mL量筒;c.烧杯;d.托盘天平;e. 500 mL容量瓶;f.胶头滴管;g.玻璃棒,请从其中选取必要的仪器,按各仪器第一次使用先后顺序排序: (填编号)。
③在配制过程中,下列实验操作对所配制盐酸物质的量浓度有何影响?(在空格中填 “偏高”、“偏低”或“无影响”):
定容时俯视观察_________;
定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水__________。
18.(共6分)
已知A、B、C均为常见单质,其中A是金属,B、C是非金属,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。

请回答下列问题:
(1)若常温下,B、C均为气体,D为黑色磁性固体,则C的化学式为 , A和E反应生成D的化学方程式为 。
(2)若常温下,B为气体,C为黑色固体粉末,则金属A的原子结构示意图为 , A和E在一定条件下反应生成D的化学方程式为 。
17.(共6分)
“比较法”是化学研究的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如: 2Na2O2+2CO2=2Na2CO3+O2, Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、Na2O2与SO3(g)反应的化学方程式:
、
(2)当1 mol SO3(g)参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 (填“最低”、“中间”或“最高”)价时,其氧化物与过氧化钠反应就有O2 生成。
16.(共8分)
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是 、S
、S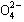 、Cl- 、C
、Cl- 、C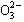 的某一种。
的某一种。
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1) 、(2)实验事实可推断它们的化学式为:
A. B. C. D.
15.(共8分)
(1)下面是唐朝刘禹锡描写沙里淘金的一首诗,其中有的诗句可能包含了化学实验现象或化学实验过程,请在这样的诗句后面写出相应的实验现象或实验过程。
日照澄洲江雾开,
淘金女伴满江隈。 美人首饰王侯印,
尽是沙中浪底来。
(2)某小苏打溶液中含NaHCO3有16.8 g,加入一定物质的量的单质或化合物X,恰好使溶液中溶质只有Na2CO3,且无沉淀产生。请你填写出X的化学式和物质的量。
例如: X为 NaOH 时,物质的量为 0.2 mol ;
①X为 时,物质的量为 ;
②X为 时,物质的量为 ;
14.下列化学反应的离子方程式,书写不正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++ SO42- = BaSO4↓
B.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO +2H2O
+2H2O
C.氯化亚铁溶液中通入少量氯气:Cl2+ 2Fe2+=2Fe3+ +2Cl-
D.碳酸钙加入稀盐酸: CaCO3+2H+=Ca2+ +CO2↑+H2O

 承德市联校2010-2011学年第一学期期末联考高一化学试卷
承德市联校2010-2011学年第一学期期末联考高一化学试卷
第Ⅱ卷(非选择题 共58分)
13. 下列叙述中,正确的是
A.0.3 mol/L的Na2SO4溶液中含有Na+ 和SO42-的总物质的量为0.9 mol
B.当1 L水吸收标准状况下的22.4 L氯化氢时所得盐酸的浓度是1 mol/L
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+ 和SO42-的物质的量相等,则K+ 和Cl-的物质的量浓度一定相同
D.10 ℃时,0.35 mol/L 的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10 ℃时,它的物质的量浓度仍为0.35 mol/L
12.下图是某品牌饮用矿泉水的标签的部分内容。下列说法正确的是
|
A.标签上给出的离子的物理量是物质的量浓度
B.任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L 之内
C.该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4 mol/L
D.一瓶该品牌饮用矿泉水中SO42-的物质的量不超过1×10-5 mol
11.下列关于实验问题处理方法或操作不正确的是
A.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
B.在实验室,不能品尝药品
C.熄灭实验桌上燃着的酒精,简便合理的方法就是用湿抹布盖灭
D.配制稀硫酸时,先在烧杯中加一定体积的水,再边搅拌边沿杯壁加入浓硫酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com