
题目列表(包括答案和解析)
9.(临沂)将X、Y、Z三种金属,如果把X、Y和Z分别投入到稀盐酸中,只有Y溶解并产生气泡,X、Z不反应;如果把X和Z分别放入硝酸银溶液中,过一会儿,在X表面有银析出,而Z没有变化。则X、Y、Z的金属活动性顺序为( )
A.Y>X>Z B.X>Y>Z
C.Z>Y>X D.X>Z>Y
15.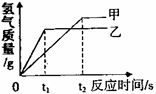 (南昌)将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如右图。关于甲、乙两金属判断合理的是
(南昌)将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如右图。关于甲、乙两金属判断合理的是
A.铁、镁 B.铁、锌
C.锌、铁 D.锌、镁
19(扬州)为探究Zn和Cu的金属活动性强弱,提供的试剂有:Zn、Cu、H2SO4溶液、ZnSO4溶液、CuSO4溶液。下列说法正确的是
A.选用两种试剂可实现实验目的
B. ZnSO4溶液中加人Cu不能探究金属活动性强弱
C.最多只能设计一种实验方案
D.根据 Zn和Cu的硬度能判断金属活动性强弱
13.(南昌)往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是( )
A.滤渣中一定有Fe粉 B.滤渣中一定有Cu粉
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu 2+
17.(镇江)R为金属,发生如下反应:R+CuSO4=Cu+RSO4。下列说法错误的是
A.该反应为置换反应 B.R的金属活动性比Cu强
C.该金属可以是Al D.若R为Fe,反应后溶液的质量会减小
20.(常州)如右图,一木块漂浮于X中,向X中缓缓加入(或通入)少量物质Y后最终木块上浮,则X与Y可能是(溶液的体积变化忽略不计)
|
序号 |
X |
Y |
|
① |
水 |
食盐 |
|
② |
氢氧化钙溶液 |
二氧化碳 |
|
③ |
稀硫酸 |
镁粉 |
|
④ |
硫酸铜溶液 |
铁粉 |
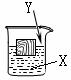
A.②④ B.①③ C.①②③ D.②③④
34.(上海)我国是世界上最早使用胆铜法冶炼铜的国家,冶炼过程中发生的一个主要反应是:Fe+CuSO4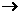 Cu+FeSO4 。该反应属于
Cu+FeSO4 。该反应属于
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
15.(湛江)电子工业制作电路板的过程中,用FeCl3溶液来溶解电路板中多余的铜,反应如下: 2FeCl3+Cu==2FeCl2+CuCl2。FeCl3溶液也可跟铁发生反应:2FeCl3+Fe==3FeCl2。现向FeCl3溶液中加入一定量的铁粉和铜粉,充分反应后,发现有固体剩余。下面有关说法正确的是
A.向剩余的固体加入稀盐酸,若无气体放出,说明反应后的溶液中没有Cu2+
B.若剩余固体是铜与铁的混合物,则说明两种金属都有部分溶解
C.剩余固体可能只含有铜
D.剩余固体中如果有铁,一定也有铜
7.(娄底)金属活动性顺序在工农业生产和科学研究中有重要应用,常见金属在溶液中的活动性由强至弱的顺序及元素名称、符号均正确的一组是
A.金Au>银Ag>铜Cu B.钾K>钙Ca>钠Na
C.锌Zn>铁Fe>贡Hg D.铝Cl>镁Mg >锌Zn
18.(娄底)除去下列各物质中的少量杂质,所用方法不可行的是
|
选项 |
物质 |
杂质 |
除去杂质的方法 |
|
A |
Cu粉 |
Fe粉 |
用磁铁吸出 |
|
B |
NaCl |
泥沙 |
加水溶解、过滤、蒸发 |
|
C |
NaOH |
Na2CO3 |
滴入足量稀盐酸至不再产生气泡 |
|
D |
O2 |
水蒸气 |
通过盛有浓硫酸的洗气瓶 |
31.(娄底)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
|
|
加入稀硫酸的质量(g) |
充分反应后剩余固体的质量(g) |
|
第1次 |
20 |
17.4 |
|
第2次 |
20 |
14.8 |
|
第3次 |
20 |
12.2 |
|
第4次 |
20 |
12.0 |
|
第5次 |
20 |
m |
试回答下列问题:
(1)上述表格中m的值为 70 ;
(2)黄铜样品中锌的质量分数为 71 ;
(3)所用稀硫酸中硫酸的质量分数是多少? 72
31题: 70. 12.0(或12) 71. 40% (每空1分)
72.[共3分,化学方程式1分,计算过程1分,结果1分(无计算过程不给分)]
解:设所用稀硫酸中硫酸的质量分数为x,据题意得:
Zn + H2SO4 = ZnSO4 + H2↑ …………1分
65 98
20g-17.4g=2.6g 20g·x
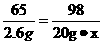 …………1分
…………1分
x=19.6% …………1分
答:所用稀硫酸中溶质的质量分数为19.6%。(合理解法均给分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com