
题目列表(包括答案和解析)
22.4L 2×74.5g 183g
 x y 18.3g(49.8-31.5)
x y 18.3g(49.8-31.5)
∴ x = 2.24 L y = 14.9 g
答:⑴ 通入Cl2的体积为2.24 L ⑵ 生成KCl的质量为14.9 g

25.(6分)解:设通入Cl2的体积为x,生成KCl的质量为y。
原KI溶液中m(KI) = 0.3 L×1 mol·L-1×166g·mol-1 = 49.8 g
Cl2 + 2KI === 2KCl + I2 △m
24.(14分) (1)Li ;硼; 略 (2)HClO4、高氯酸、 NaOH 离子 (3 )NH3>PH3
)NH3>PH3
(4)NH3 + HNO3 = NH4NO3 (5)Mg(OH)2 + 2H+ = Mg2+ + 2H2O
22.(14分)(1)取少量样品,溶解,加入BaCl2溶液,充分振荡,有白色沉淀,证明Na2O2已经变质 (2)取少量样品放入试管中,再加入适量的水,把带有火星的木条伸入试管中,木条复燃,证明样品中仍有Na2O2
(3)①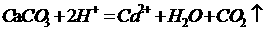
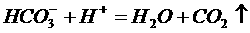
②吸收未反应的CO2 ③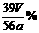
23 .(12分)(1) Ca Na2CO3 (2)Cl2 + H2O = H
.(12分)(1) Ca Na2CO3 (2)Cl2 + H2O = H + Cl
+ Cl + HClO
+ HClO
|
 Na2CO3
+ H2O + CO2
Na2CO3
+ H2O + CO2
(4) 2HClO ==== 2HCl+O2↑ (5) 2F2 + 2H2O=4HF+O2
26.(6分)用NaOH与Na2CO3·nH2O的混合物共28g配制成100mL溶液,测得该溶液中c(Na+)=4mol·L-1。另取相同质量的上述混合物,加入足量的盐酸完全反应后,放出的气体在标准状况下的体积为3.36L,试计算:(1)原混合物中NaOH的质量分数。(2)Na2CO3·nH2O中的n值。

25.(6分)在标准状况下,把一定体积的Cl2通入300 mL 1 mol·L-1的KI溶液中,充分反应后,将溶液蒸干,灼烧,得31.5 g残渣。试计算:⑴ 通入Cl2的体积;⑵ 生成KCl的质量。
24.(14分)现有8种元素的性质、数据如下表所列,它们属于第二或第三周期(即3-18号元素)。

|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高或最低化合价 |
|
+2 |
+1[ |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是_________,其原子结构示意图为___________________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,名称是 ;碱性最强的化合物是 ; 属 化合物(填“离子”或“共价”)。
(3)比较④和⑦的氢化物的稳定性(用化学式表示) 。
(4)写出⑦的最高价氧化物对应水化物与其氢化物反应的方程式_____________________。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:
.
23.(12分)下图中,A到L为中学化学常见物质。A为金属单质,C(黄绿色)、E为气体单质,在常温下B为无色液体,I为无色、无味气体, K由四种元素组成且焰色反应为黄色,且将I持续通入D溶液或G溶液中,现象均为先有白色沉淀生成后沉淀消失,反应②可用于工业生产。

回答下列问题:
(1)A的化学式为 ;J的化学式为 。
(2)反应①的离子方程式为 。
(3)反应②的化学方程式为____________________ __反应③的化学方程式为 。
(4)L见光分解的化学方程式为 。
(5)E与某气体单质M在冷暗处就能剧烈化合并发生爆炸,则M与水反应的化学方程式为 。
22. (14分)过氧化钠保存不当容易变质,生成Na2CO3。
(1)某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液,证明过氧化钠已经变质
(2)检验样品中还有过氧化钠的方法是 
(3)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
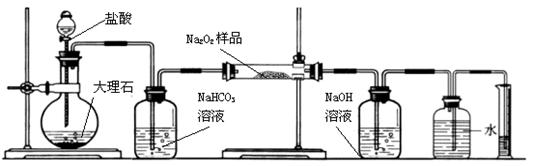
(A) (B) (C) (D) (E) (F)
上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置A和B中发生反应的离子方程式:
装置A:
装置B:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
21.(7分)实验室要配制100mL 2 mol·L-1 NaOH溶液,请回答下列问题。
⑴配制过程中不需要使用的化学仪器有 (填选项的字母)
A.烧杯 B.100 mL容量瓶 C.漏斗 D.胶头滴管  E.玻璃棒
E.玻璃棒
⑵用托盘天平称取氢氧化钠,其质量为
⑶实验开始前,需要检验容量瓶是否
⑷下列主要操作步骤的正确顺序是 (填序号)
① 称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
② 用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③ 待冷却至室温后,将溶液转移到100mL容量瓶中;
④ 盖好瓶塞,反复上下颠倒,摇匀;
⑤ 用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com