
题目列表(包括答案和解析)
15、(达州)纯碱(Na2CO3)是一种重要的盐类物质,在化学工业中用途极广。工业上通常用氨碱法来生产。小红同学为探究纯碱的化学性质进行了猜想,并设计实验进行验证。请你帮助她将下列实验报告填写完整。
|
猜想 |
实验操作 |
实验现象 |
结论(或化学方程式) |
|
猜想一:Na2CO3溶液显碱性 |
取少量Na2CO3溶液于试管中,滴入2-3滴酚酞试液,振荡 |
|
溶液显碱性 |
|
猜想二:能与酸反应 |
取少量溶液于试管中,然后滴加稀盐酸 |
有大量气泡产生 |
化学方程式 |
|
猜想三:能与Ca(OH)2反应 |
向盛有少量Na2CO3溶液于试管中,滴加澄清石灰水 |
产生白色沉淀 |
化学方程式 |
|
猜想四:能与BaCl2反应 |
|
产生白色沉淀 |
Na2CO3+BaCl2=BaCO↓+2NaCl 反应的基本类型为 |
[交流与反思] 若用稀硫酸代替稀盐酸进行实验,是否与猜想二相同? (填“是”或“否”)。
|
猜想 |
实验操作 |
实验现象 |
结论(或化学方程式) |
|
|
|
溶液变为红色 |
|
|
|
|
|
Na2CO3+2HCl
= 2NaCl+H2O+CO2↑ |
|
|
|
|
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ |
|
|
取少量Na2CO3溶液于试管中,滴入BaCl2溶液 |
|
复分解反应 |
是
(1)从甲物质的溶解度曲线可以得到哪些信息(请写出其中的一条)___________________________。
(2)t1℃时,甲、乙两种物质的溶解度较大的是___________。
(3)t1℃时,将20g甲物质放入50g水中,充分搅拌能否全部溶解____________(填“能”、“不能”或“无法判断”)。
(4)将一定量t2℃时甲物质的饱和溶液降温到t1℃时,该过程中没有发生改变的是___________(填序号)
A.溶质质量 B.溶液质量 C.溶剂质量 D.溶质的质量分数
20.(1)甲的溶解度随着温度的升高而变大(其他合理答案也可)(2)乙(3)不能(4)C
23.(1)解:设样品中Fe3O4的质量为x。
Fe3O4+4CO  3Fe + 4CO2
3Fe + 4CO2
232 176
x 5.5g
 解得x=7.25g
解得x=7.25g
样品中Fe3O4的质量分数为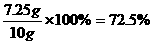
答:略
(2)解:设样品中杂质的质量为x。
Fe3O4+4CO  3Fe + 4CO2
3Fe + 4CO2
232 168
10g-x 8g-x
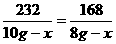 解得x=2.75g
解得x=2.75g
样品中Fe3O4的质量分数为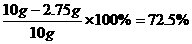
答:略
23. (宽甸)为了测定某些磁铁矿中四氧化三铁的质量,甲、乙两组同学根据磁铁矿与一氧化碳反应的原理,分别利用两种方法测定了磁铁矿样品中四氧化三铁的质量分数。已知磁铁铁矿与一氧化碳反应的化学方程式如下(假设磁铁矿中的杂质不参加反应):
Fe3O4+4CO  3Fe + 4CO2。(计算最终结果保留小数点后一位)
3Fe + 4CO2。(计算最终结果保留小数点后一位)
(1)甲组同学取该磁铁样品10g,与足量的一氧化碳充分反应,并将产生的气体通入足量的氢氧化钠的溶液中,溶液的质量增加了5.5g。请你根据甲组同学的实验数据,计算出磁铁矿样品中四氧化三铁的质量分数。
(2)乙组同学取该磁铁样品10g,与足量的一氧化碳充分反应,测得反应后固体物质的质量为8g。请你根据乙组同学的实验数据,计算出磁铁矿样品中四氧化三铁的质量分数。
19.(1)2%-4.3% 混合物 (2)增加反应物的接触面积,加快反应 (3)C+O2 CO2
CO2
3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
19.(宽甸)(8分)从楚王陵中出土的铁器中发现了迄今世界上最早的炒钢技术,说明中国早在公元前2世纪就掌握了炒钢技术。
炒钢是一种冶炼技术,冶炼时先将生铁加热到液态或半液态,然后靠鼓风或加进精矿粉,降低生铁的含碳量,使其成钢。由于在冶炼中要不断搅拌,好象炒菜一样,因而得名。 (1)生铁的含碳量为 。炼得的钢是 (选填“纯净物”或“混合物”)。
(2)将生铁加热到液态或半液态并不断搅拌的原因是什么?
(3)写出向液态生铁中鼓风和加进精矿粉(以赤铁矿为例)所发生反应的化学方程式。
47.解:(1)反应生成的氢气质量=97g-96.8g=0.2g(2分)
(2)设生铁中铁的质量为x,生成硫酸亚铁质量为y,则
Fe + H2SO4 = FeSO4 + H2↑
56 152 2
x y 0.2g
x=0.2g×56/2=5.6g (1分)
y=0.2g×152/2=15.2g (1分)
Fe%=5.6/6×100%=93.3% (1分)
(3)不溶性杂质的质量=6g-5.6g=0.4g (1分)
FeSO4%=15.2/(50+7-0.4-0.2)×100%=21.6% (2分)
答:(1)生成氢气0.2g,(2)生铁中铁的质量分数为93.3%,(3)反应所得溶液中FeSO4的质量分数约为21.6%。
(注:其他合理解答,只要思路清晰,答案正确均应给分)
47.(乐山)(8分)生铁是铁和碳的合金。为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完全反应(假设杂质不参与反应)。测得的实验数据如下:
|
|
反应前 |
反应后 |
|
烧杯及其中物质的质量 |
97.0g |
96.8g |
请你完成有关计算(结果保留一位小数):
(1)反应放出的氢气是多少?
(2)生铁样品的质量分数是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
32. (上海)镁带能在CO2气体中燃烧:2Mg+CO2点燃2MgO+C,该反应中的还原剂是
A.Mg B. CO2 C. MgO D.C
25.(5分)(1)Fe3O4(1分) (2) 3CO+Fe2O3 高温 2Fe+3CO2(2分)
(3)B(1分) (4)氧气(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com