
题目列表(包括答案和解析)
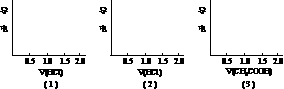
3.在下列问题中:
(1)把体积为2V的HCl加到等浓度(mol/L)、体积为V的NaOH中;
(2)把体积为2V的HCl加到等浓度(mol/L)、体积为V的NH3·H2O中;
(3)把体积为2V的CH3COOH加到等浓度(mol/L)、体积为V的NH3·H2O中;
请按下列要求作图:
2.人体血浆中正常的pH值为7.35~7.42,如果pH值高于7.50或低于7.20分别表现出代谢性碱中毒或酸中毒。为纠正酸碱失调,临床上一般给患者补给化学药物(即可口服又可静脉注射)来纠正。试分别指出补给的药物名称及纠正的过程。
1.已知硫酸铅难溶于水,也难溶于硝酸,但可溶于醋酸铵(NH4Ac)溶液形成无色溶液,其化学方程式为:PbSO4+2NH4Ac Pb(Ac)2+(NH4)2SO4。当在Pb(Ac)2溶液中通入H2S时,有黑色PbS生成。表示这个反应的有关反应离子方程式正确的是
Pb(Ac)2+(NH4)2SO4。当在Pb(Ac)2溶液中通入H2S时,有黑色PbS生成。表示这个反应的有关反应离子方程式正确的是
A、Pb(Ac)2+H2S PbS↓+2HAc
PbS↓+2HAc
B、Pb2++H2S PbS↓+2H+
PbS↓+2H+
C、Pb2++2Ac-+H2S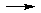 PbS↓+2HAc
PbS↓+2HAc
D、Pb2++2Ac-+2H++S2-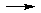 PbS↓+2HAc
PbS↓+2HAc
1.(2008复旦)0L 0.10 mol·L-1 H2SO4水溶液中,其[H+]浓度最接近于_________。
A、0.22mol·L-1 B、0.20mol·L-1 C、0.11mol·L-1 D、0.10mol·L-1
4.外加酸时保持pH值没有显著变化的最主要因素是______________。
(2006年复旦)已知H2CO3的二级电离常数为K2,a mol·L-1 NaHCO3溶液(pH=8.3)中CO32-的为
A、10-8.3aK2 mol·L-1 B、108.3aK2 mol·L-1
C、10-8.3a/K2 mol·L-1 D、108.3a/K2 mol·L-1
(2008武大)人体的血液pH值维持在7.4左右,这一pH值范围最适合于细胞代谢及整个机体的生存。人体进行新陈代谢所产生的酸或碱进入血液内并不能显著的改变血液的pH值,这是因为人体的血液是缓冲溶液,在血液中存在着许多缓冲对,主要有H2CO3-NaHCO3、NaH2PO4-Na2HPO4、血浆蛋白-血浆蛋白盐、血红蛋白-血红蛋白盐等等。其中以H2CO3-NaHCO3缓冲对起主要缓冲作用。若H2CO3的Ka1=4.30×10-7,则血液中HCO3-/H2CO3的比值应维持在多少?
3.影响上述体系pH变动0.1~0.2个单位的因素是______________;
2.决定体系pH值的最主要因素是______________;
(2007交大)缓冲溶液可以由浓度较大的弱酸及其相应的盐溶液组成,其溶液能够保持稳定的pH值,溶液pH的计算公式为:pH=pKa+lg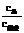 ,其中Ka为弱酸的电离常数。相应的,由弱碱及其相应的盐溶液组成的缓冲溶液,其溶液pOH=pKb+lg
,其中Ka为弱酸的电离常数。相应的,由弱碱及其相应的盐溶液组成的缓冲溶液,其溶液pOH=pKb+lg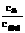 。试就HAc-NaAc缓冲体系,回答:
。试就HAc-NaAc缓冲体系,回答:
1.上述缓冲溶液呈__________性(填“酸性、中性或碱性”)
2.缓冲溶液
缓冲溶液是一类能够抵制外界加入少量酸和碱的影响,仍能维持pH值基本不变的溶液。该溶液的这种抗pH变化的作用称为缓冲作用。缓冲溶液通常是由一或两种化合物溶于溶剂(即纯水)所得的溶液,溶液内所溶解的溶质(化合物)称之为缓冲剂,调节缓冲剂的配比即可制得不同pH的缓冲液。
下表列出某些人体体液的pH值:
|
体 液 |
pH |
体 液 |
pH |
|
血 清 |
7.35~7.45 |
大肠液 |
8.3~8.4 |
|
成人胃液 |
0.9~1.5 |
泪 |
6.6~6.9 |
|
唾 液 |
6.3~7.1 |
尿 |
4.8~7.5 |
|
胰 液 |
7.5~8.0 |
脑脊液 |
7.35~7.45 |
缓冲溶液是由共轭酸碱对组成,所谓共轭酸碱对是指两种缓冲剂相差一个质子。缓冲溶液可以由浓度较大的弱酸及其相应的盐溶液组成,其溶液能够保持稳定的pH值,溶液pH的计算公式为:pH=pKa+lg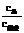 ,其中Ka为弱酸的电离常数。相应的,由弱碱及其相应的盐溶液组成的缓冲溶液,其溶液pOH=pKb+lg
,其中Ka为弱酸的电离常数。相应的,由弱碱及其相应的盐溶液组成的缓冲溶液,其溶液pOH=pKb+lg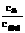
[例3](1)含有HAc和NaAc各为0.1mol·L-1的缓冲溶液的pH是多少?
(2)在1L上述缓冲溶液中加入0.01mol HCl后,溶液的pH是多少?
(3)在这1L缓冲溶液中加入0.01mol NaOH后,溶液的pH是多少?
(4)将上述溶液加水稀释100倍时,pH是多少?
通过计算,我们得出结论:
①外加少量强酸、强碱或加水稀释时,缓冲溶液的pH值基本不变。
②缓冲溶液pH首先决定于pKa或pKb,即决定于弱酸或弱碱的平衡常数的大小,其次决定于ca/cb的比值。对于某一确定的缓冲对,由于pKa和pKb是一个常数,改变ca/cb的值,可以配制不同pH值的缓冲溶液。
1.沉淀溶解平衡
任何难溶的电解质在水中总是或多或少溶解的,绝对不溶的物质是不存在的。难溶电解质在水中所溶的那部分一般是完全电离的。
在一定条件下,难溶强电解质AmBn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,叫做沉淀-溶解平衡。这时,离子浓度的乘积为一常数,叫做溶度积常数Ksp。
AmBn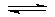 mAn++nBm-。质量作用定律适用于这个平衡,可得溶度积常数表达式:Ksp=[An+]m[Bm-]n。溶度积常数和溶解度(s)的值都可用来表示物质的溶解能力。但用溶度积常数直接比较时,物质的类型必须相同。
mAn++nBm-。质量作用定律适用于这个平衡,可得溶度积常数表达式:Ksp=[An+]m[Bm-]n。溶度积常数和溶解度(s)的值都可用来表示物质的溶解能力。但用溶度积常数直接比较时,物质的类型必须相同。
①AB型物质:Ksp=[A+][B-]=s2;
②AB2(或A2B)型物质:Ksp=[A2+][B-]2=s·(2s)2=4s3;
③A2B3型物质:Ksp=[A3+]2[B2-]3=(2s)2·(3s)3=108s5
根据Ksp可以判断沉淀的生成、溶解或是维持原状,这叫溶度积规则。其内容是:
①当Qc=[An+]m[Bm-]n=Ksp时,体系处于平衡状态,是饱和溶液。
②当Qc=[An+]m[Bm-]n>Ksp时,会生成沉淀,溶液处于过饱和状态。
③当Qc=[An+]m[Bm-]n<Ksp时,沉淀会溶解,溶液为未饱和。
注意:
①Ksp与温度有关。温度升高,Ksp增大。
②溶度积Ksp与溶解度s都可以用来表示物质的溶解能力,它们之间可以互换。同类型(指组成比)难溶电解质,Ksp越小,则s(以物质的量浓度表示)愈小;不同类型的难溶电解质,不能根据Ksp大小来比较s的大小。
③沉淀剂能使被沉淀的离子沉淀完全,但也不是沉淀剂愈多愈好,一般按化学计量比过量20~50%为宜,过量太多,反而使溶解度增大。
④有时沉淀完全的标准是:剩余离子浓度≤10-6mol·dm-3。
[例1]在某酸性溶液中含有Fe3+和Fe2+,它们的浓度均为1.00mol•L-1 向溶液中加碱(忽略体积变化),使其pH=3.00,该溶液中残存的Fe3+和Fe2+离子浓度各为多少?
[例2]在Cl-和CrO42-离子浓度都是0.100mol•L-1的混合溶液中逐滴加入AgNO3溶液(忽略体积变化),问AgCl和Ag2CrO4哪一种先沉淀?当Ag2CrO4开始沉淀时,溶液中Cl-离子浓度是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com