
题目列表(包括答案和解析)
2.丙酮与碘在酸性介质中发生如下的反应:CH3COCH3+I2 CH3COCH2I+H++I-
CH3COCH2I+H++I-
实验证明,在250C时,该反应的速度与物质量的浓度之间存在着如下关系:v=k[CH3COCH3][H+]。该式中k为速度常数,在该温度下,k=2.23×10-3dm3/mol·s,试推测开始时反应速度和反应后期反应速度的变化情况?
1.制备HI(aq)的一种简便方法是:通H2S入I2的悬浮液中,产物HI(aq)的浓度可高达50%。
(1)写出反应方程式。
(2)H2S、I2的溶解度都不大。为什么HI(aq)浓度可高达50%?
(2007厦大)人体中某种酶的催化反应活化能是50.0kJ·mol-1,正常人的体温是37.00C,问发烧至400C的病人体中,该反应的速率增加了百分之几?
(2007年武大)某抗菌素在人体血液中呈现一级反应。已知一级反应公式为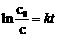 。式中c0为起始浓度,c为t时刻时的浓度,k为速率常数。如果在上午8时给病人注射一针抗菌素,然后在不同时刻后测定抗菌素在血压中的质量浓度,得到如下数据:
。式中c0为起始浓度,c为t时刻时的浓度,k为速率常数。如果在上午8时给病人注射一针抗菌素,然后在不同时刻后测定抗菌素在血压中的质量浓度,得到如下数据:
|
T / h |
4 |
8 |
12 |
16 |
|
c/mg∙dm-3 |
4.80 |
3.26 |
2.22 |
1.51 |
若抗菌素在血液中的质量浓度不低于3.7mg∙dm-3才有效。问何时注射第二针?
(2008武大)对于一气体可逆反应mA(g)+nB(g) pC(g)+qD(g),在一定温度下达到化学平衡后,体系中各物质的平衡浓度有如下关系:Kc=
pC(g)+qD(g),在一定温度下达到化学平衡后,体系中各物质的平衡浓度有如下关系:Kc= ,Kc为浓度平衡常数;达平衡时,平衡常数也可用各气体的分压表示:Kp=
,Kc为浓度平衡常数;达平衡时,平衡常数也可用各气体的分压表示:Kp=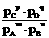 。Kp称为压力平衡常数。Kc和Kp均只是温度的函数。
。Kp称为压力平衡常数。Kc和Kp均只是温度的函数。
(1)根据理想气体状态方程和分压定律可求出Kc和Kp的关系为Kp=Kc(RT)Δn,其中R为气体常数,T为绝对温度。则Δn=___________________。
(2)在250C时将固体NH4HS放在真空容器中,由于部分分解成NH3和H2S,产生的压力为500mmHg柱,分解率为x;若将NH4HS放入一已含有H2S气体,且其压力为300mmHg柱,分解率为y,则压力应该增加多少?x与y的关系:x__________y(填“大于、等于、小于”)
3.化学平衡常数
对于气相反应,平衡时各物质的分压不变,仍有类似的关系式: 平衡时,
平衡时,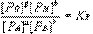 ,Kp也是一种经验平衡常数,称为分压平衡常数。而用浓度表示的经验平衡常数,则称为浓度平衡常数Kc。
,Kp也是一种经验平衡常数,称为分压平衡常数。而用浓度表示的经验平衡常数,则称为浓度平衡常数Kc。
对于气相反应,既有Kc,也有Kp,表达的是同一平衡态,但数值可以不同。Kc和Kp之间可以相互换算,相关的式子有:pV=nRT,p=(n/V)RT,p=CRT,C为浓度(换算时,要注意各物理量的单位。)
在书写Kc或Kp表达式时,只写浓度或分压可变的溶液相和气压,固态和纯液态物质,不写入。
对于同一可逆反应而言,K只与温度有关。
2.阿累尼乌斯公式
温度对反应速率的影响,主要体现在对速率常数k的影响上。Arrhenius总结了k与T的经验公式: 指数式。取自然对数,得:
指数式。取自然对数,得: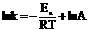 对数式。常用对数:
对数式。常用对数: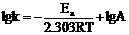 。
。
式中:k速率常数,Ea活化能,R气体常数,T绝对温度。e自然对数底,e=2.71828……,lge=0.4343=1/2.303,A指前因子,单位同k。应用阿仑尼乌斯公式讨论问题,可以认为Ea,A不随温度变化。由于T在指数上,故对k的影响较大。
根据Arrhenius公式,知道了反应的Ea,A和某温度T1时的k1,即可求出任意温度T2时的k2。由对数式, ①
①
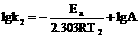 ②
②
②-①得: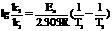 ,或用指数形式:
,或用指数形式: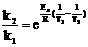 。
。
1.质量作用定律
在基元反应中,或在非基元反应的基元步骤中,反应速率和反应物浓度之间,有严格的数量关系,即遵循质量作用定律。基元反应aA+bB=gG+hH,则:Vi=ki[A]a[B]b
7.若在1.0L Na2CO3 溶液中溶解 0.010mol的BaSO4,问Na2CO3的最初浓度是多少?
6.解释下列反应中沉淀的生成或溶解的道理:
(1)Mg(OH)2能溶于盐酸也能溶于氯化铵溶液;
(2)MnS在盐酸和醋酸中都能溶解;
(3)AgCl能溶于氨水,加硝酸沉淀又重新出现。
5.一定温度下,由水电离的H+和OH-的物质的量浓度之间存在如下关系:[H+][OH-]=Kw。同样,对于难溶的盐MA,其饱和溶液中的M+和A-的物质的量浓度之间也存在着类似关系:[M+][A-]=Ksp。Ksp和Kw是不同的常数。现将足量的AgCl分别放在5mL水、10mL 0.2mol·L-1 MgCl2、20mL 0.5mol·L-1 NaCl和40mL 0.3mol·L-1 HCl溶液中溶解达到饱和,各溶液中Ag+离子浓度的数值,依次为a、b、c、d,它们由大到小的排列顺序为__________________。
4.已知重水(D2O)和乙酸之间会发生氢交换:
D2O+CH3COOH CH3COOD+HDO
CH3COOD+HDO
又知次磷酸(H3PO2)与D2O之间也能发生氢交换,但次磷酸钠(NaH2PO2)等次磷酸盐与D2O之间不能发生氢交换。据此,请写出次磷酸的结构式,并简述理由。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com