
题目列表(包括答案和解析)
7.若同时打开二瓶同一厂家于同一日期生产的啤酒,其中A瓶温度为300C,B瓶温度为00C。问:
(1)打开并倒出时,哪瓶啤酒的泡沫多?
a、A比B多 b、A比B少 c、两瓶一样多 d、无法判断
(2)B瓶啤酒在00C时为什么是液体?
6.在相同的温度和压力下,相同质量摩尔浓度的葡萄糖和食盐水溶液的渗透压是否相同。为什么?所谓质量摩尔浓度是指1000g溶剂中所含溶质的物质的量。
5.在严寒的冬天,为什么要在汽车散热水箱中加入甘油或乙二醇等物质?
4.将等体积的纯水和糖水各一杯,放在密闭的玻璃钟罩内,一段时间后,会发现什么现象?为什么?
3.由于各种物理、化学和生物过程,从大洋中可析出含碳酸钙等的沉淀物。沉淀物中碳酸钙含量受许多因素影响,在同一纬度随深度增加而变化。例如:在北太平洋中部某处测得在2000m深处碳酸钙占沉积物80%以上,由2000~4500m几乎直线下降,4500m以下的沉积物中几乎没有碳酸钙成分,而且表层水中的碳酸钙沉积物下沉时就会溶解。
(1)这种现象说明了什么问题?
(2)在高纬度地区比在低纬度地区大洋沉积物中碳酸钙是多还是少?为什么?
2.潜水员进行水下作业和作业后,如果不采取对应措施,就会因血浆中溶氮量增多而发生“潜涵病”。所以现今已采用以氦代氮的作业后逐步减压等安全措施。如果某潜水员在温度为180C的40.0m深的水下作业,并以纯氧和空气1:4体积比的富氧空气供他呼吸。如作业完毕后迅速升到水面,试计算:
(1)潜水员的血浆中将释放多少升氮气?已知此时设血浆总量是4.00dm3。氮气在血浆中的溶解度和在水中相同。
(2)说明上述操作条件是否安全。
1.相对湿度的定义为:在某一温度下,空气中水蒸气的分压与同温度下的饱和水蒸气压之比。试计算:
(1)303K时相对湿度为100%时1dm3空气中含水汽的质量。
(2)323K时相对湿度为80%时1dm3空气中含水汽的质量。
已知:水的饱和蒸汽压:303K为4239.6Pa;323K为12332.3Pa。
(2007清华)下图是273K时CH3F蒸汽的 ~p图。试根据图求出CH3F摩尔质量。
~p图。试根据图求出CH3F摩尔质量。
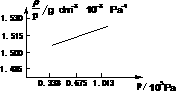
(2005年交大)试解释:
(1)为什么海鱼不能生活在淡水中?
(2)在淡水中游泳时眼睛会红肿,并有疼痛感觉,而在海水中就不会有这种不适。为什么?
(3)为什么临床常采用质量分数为0.9%生理盐水和质量分数为5%葡萄糖溶液作输液?
(4)普通水和海水在相同条件下,哪一种蒸发的比较快?为什么?
(2006厦大)有两杯新配制的蒸馏水,其中一杯通入纯净的空气使之饱和,这两杯蒸馏水在通常条件下,沸腾的温度与开始结冰的温度有何差别?为什么?
若要配制饱和H2S水溶液,该用哪一杯蒸馏水较好,为什么样?(可用反应方程式表达)
2.稀溶液的依数性
包括三个方面的内容:①溶液的饱和蒸气压下降;②沸点升高和凝固点下降;③渗透压。
(1)溶液的饱和蒸气压下降
单位时间内由液面蒸发出的分子数和由气相回到液体内的分子数相等时,气、液两相处于平衡状态,这时蒸汽的压强叫做该液体的饱和蒸汽压,通常称为蒸汽压。
(2)溶液沸点升高
含有非挥发性溶质的溶液其沸点总是高于纯溶剂的沸点。对稀溶液来说,蒸汽压随温度升高而增加,当它的蒸汽压等于大气压强时,液态开始沸腾,这时的温度成为该液体的沸点。
(3)溶液凝固点下降
水溶液的凝固点是指溶液中的水与冰达成平衡的温度,难挥发的非电解质稀溶液的凝固点下降与溶液的质量摩尔浓度成正比,而与溶质的的性质无关。
(4)渗透压
具有渗透压是溶液的依数性质,它产生的根本原因也是相变界面上可发生变化的分子个数不同引起的。经过长期研究,人们发现:①温度相同时,渗透压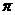 和溶液的体积摩尔浓度成正比;②浓度相同时,
和溶液的体积摩尔浓度成正比;②浓度相同时,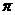 和温度T成正比,即:
和温度T成正比,即: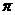 =
=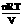 ,即
,即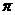 V=nRT
V=nRT
1.理想气体状态方程
理想气体又称“完全气体”(perfect gas),是理论上假想的一种把实际气体性质加以简化的气体。人们把假想在任何情况下都严格遵守气体三定律的气体称为理想气体。理想气体具有如下特点:
①分子体积与气体体积相比可以忽略不计
②分子之间没有相互吸引力
③分子之间及分子与器壁之间发生的碰撞不造成动能损失
一切实际气体并不严格遵循这些定律,只有在温度不太低,压强不太高时可将真实气体视为理想气体。换言之,理想气体是一种理想化的模型,实际并不存在。理想气体是一切实际气体压强趋于零的极限。这是因为p→0时,V→∞,即分子间距很大。此时分子本身体积和分子间引力均可忽略不计。实际气体中,凡是本身不易被液化的气体,它们的性质很近似理想气体,其中最接近理想气体的是氢气和氦气。
在各种温度、压强的条件下,其状态皆服从方程pV=nRT的气体,称为理想气体状态方程,或称理想气体定律。式中p是气体分压,V是气体体积,n是气体物质的量,T是气体的绝对温度,R是气体通用常数,它随其他物理量的单位不同而不同。
|
物理量 |
p |
V |
n |
T |
R |
|
国际单位 |
Pa |
m3 |
mol |
K |
8.314 |
|
kPa |
dm3 |
mol |
K |
8.314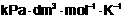 |
|
|
常用单位 |
atm |
dm3 |
mol |
K |
0.082 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com