
题目列表(包括答案和解析)
5.比较下列各对物质的性质,并扼要说明理由。
(1)离子半径:Li+与Be2+
(2)稳定性:Fe2+与Fe3+
(3)第一电离能:N与O
4.五种元素的原子电子层结构如下:
A:1s22s22p63s23p63d54s2
B:1s22s22p63s2
C:1s22s22p6
D:1s22s22p63s23p2
E:1s22s1
试问:
(1)哪种元素是稀有气体?
(2)哪种元素最可能生成具有催化性质的氧化物?
(3)哪种元素的原子的第一电离能最大?
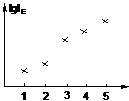
3.电离能(I)是指基态的气态原子失去电子形成气态阳离子时所吸收的能量。下图表示某主族元素X的头五级电离能的对数值,试推测X可能是哪些元素?
2.在二维空间里,Na原子的核外电子排布式应表示为____________。
1.若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是
A、1 B、3 C、5 D、6
(2006年北大)已知某元素的原子序数是50,试推测该元素
(1)原子的电子层结构;
(2)处在哪一周期哪一族?
(3)是金属还是非金属?
(4)最高氧化态及其氧化物的酸碱性。
(2006年交大)以前三周期元素为例,说明其常见非金属单质的存在形态与原子核外电子结构的关系。
(2008交大)具有单电子的微粒(原子、离子或原子团)都具有顺磁性,可用磁矩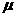 来量度。若单电子数目越多,其磁矩就越大。下列原子N、O、Cl和Mn原子中哪一个磁矩最大?
来量度。若单电子数目越多,其磁矩就越大。下列原子N、O、Cl和Mn原子中哪一个磁矩最大?
165.(2006复旦)元素氯的相对原子质量35.45,氯有35Cl、37Cl两种稳定同位素。相对原子质量35Cl=34.97,37Cl=36.97。35Cl的自然丰度约为_______。
A、22% B、24% C、76% D、78%
2.元素的性质
元素性质牵涉到元素的电负性、电离能和电子亲合能。
(1)电负性
元素的电负性是指周期表中各元素的原子在分子中对成键电子的吸引能力的一种相对标度。元素的电负性愈大,表明原子在形成化学键时对成键电子的吸引力越强,非金属性也愈强。
(2)电离能
电离能(I)是指基态的气态原子失去电子形成气态阳离子时所吸收的能量。由于原子失去电子必须消耗能量克服核对外层电子的引力,所以电离能总为正值,单位常用kJ•mol-1。
电离能可以定量比较气态原子失去电子的难易,电离能越大,原子越难失去电子,其金属性越弱;反之金属性越强。影响电离能大小的因素是:有效核电荷、原子半径和原子的电子构型。
(3)电子亲合能
元素的气态基态原子获得电子成为气态阴离子所释放的能量称为该元素的电子亲合能,简称电子亲合能(E)。电子亲合能的大小反映了原子获得电子的难易。亲合能数值越大,则气态原子结合电子释放的能量越多,与电子的结合越稳定,表明该元素的原子越易获得电子,故非金属性越强。反之亦然。
1.核外电子排布
要分清楚核外的填充式和核外电子的排布式。核外电子的排布式是根据主量子数和角量子数的大小确定的。主量子数即电子层数或周期数,角量子数即电子亚层。而电子填充式要考虑能级交错。所谓能级交错现象就是某些亚层电子(如s电子)钻穿能力很强,能钻穿到离核较近的区域。从第四周期开始,一些元素原子的电子就开始发生能级交错。如:Sc的核外电子排布式:1s22s22p63s23p63d14s2;Sc的核外电子填充式:1s22s22p63s23p64s23d1。
7.芒硝是重要的化工原料,具有广泛的用途。试回答:
(1)我国广西某地蕴藏着一大型芒硝矿。从广西的地理环境看,该大型芒硝矿床应存在于地下浅层,还是地下深层?为什么?
(2)芒硝可调节室内温度,科学家利用太阳能的方法之一,是将装有芒硝的密闭聚乙烯管安装在房屋的外墙内,当太阳照射时,它能将太阳能转化为化学能,达到蓄热效果,使室内温度保持较低温度;晚上,它能将化学能转化为热能放出,使室内保持温暖。请问这是为什么?请用方程式回答。从这个意义上讲,芒硝可作什么材料?
(3)为测定Na2SO4和NaCl混合物中Na2SO4的质量分数,甲、乙两位同学按下列实验步骤进行实验:称量样品®溶解®加过量试剂A®过滤出沉淀B®洗涤沉淀®烘干称量®处理实验数据并得出结果。
a、实验时,甲同学选用AgNO3作试剂A,乙同学选用BaCl2溶液作试剂A。问哪一位同学所选用的试剂A不合理,为什么?
b、以下都是在试剂A选择正确时进行的实验:检验加入的试剂A是否已过量的方法是_______________;若实验中测得样品质量为Wg,沉淀物质量为m g,请列出实验测定结果的计算式:Na2SO4的质量分数为___________。
6.抗坏血酸(VC)的分子式C6H8O6,其结构简式为: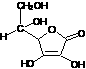 。问:
。问:
(1)它是如何显示酸性的?
(2)VC易被氧化成C6H6O6,其产物的结构式为______________。
(3)C6H6O6与H2S反应生成VC。其反应方程式为___________________。
(4)在硫酸溶液中,K2Cr2O7氧化VC成C6H6O6的反应方程式为__________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com