
题目列表(包括答案和解析)
无机化合物包括酸碱盐。由于盐种类多,考查也多。我们主要论述盐。
1.物理性质
(1)颜色
无机化合物的颜色取决于组成化合物的阳离子颜色(一般情况下,大多数阴离子是无色的)。而离子的颜色又取决于离子的电子构型。
此外,极化能力很强的不显色阳离子与变形性很大的阴离子所形成的化合物,由于有很强的相互极化作用,这类化合物也显色。
(2)熔沸点
主要取决于物质的晶体结构。晶格能越大,熔沸点越高。离子晶体、原子晶体熔沸点高,分子晶体熔沸点低。
(3)溶解性
相似相溶原理。即极性溶质易溶于极性溶剂;非极性溶质易溶于非极性溶剂。
对于8e构型金属离子所生成盐的溶解性有如下经验规律:
离子电荷少,半径大的盐往往易溶,如IA和IIA氟化物易溶;阴离子半径较大时,盐的溶解度常随金属的原子序数的增大而减小;相反,阴离子半径较小时,盐的溶解度随金属原子序数增大而增大。
酸式盐一般比正盐在水中溶解度大(除NaHCO3、KHCO3和NH4HCO3外,因为HCO3-离子通过氢键形成了双聚离子)。
2.单质化学性质
化学性质主要指活泼性。其活泼性的表现是在空气中的稳定性,同水、卤素、硫、酸(氧化性酸和非氧化性酸)、碱和盐等的特征反应。
对金属单质而言,活泼性是指其还原性;对非金属单质而言,是指其氧化性。这些性质的变化,基本上可用元素周期律的递变规律解释。
1.单质的物理性质
单质的物理性质有状态、颜色、气味、味道、导热性、导电性、延展性;以及熔点、沸点、溶解度、密度、硬度等。其中前者不能用物理量描述,后者则可以。
金属单质与非金属单质在金属光泽、导热性、导电性和延展性上一般各有明显的特征;但在熔沸点和硬度等性质上却有着较复杂的情况。这是因为不同单质的晶体在晶体类型及其组成晶体粒子有所不同。
7.传统上我们把糖类叫做碳水化合物,其通式可以写成Ca(H2O)b。
(1)现有一种技术,可将糖发酵进行无氧分解,生成两种化合物,其中一种物质是沼气的主要成分。请写出化学反应方程式,并指出a、b之间的关系。
(2)请写出不是糖类的C6(H2O)3化合物可能的5种结构简式(任意5种)。
(3)简要说明不存在b>a的Ca(H2O)b的化合物的原因。
6.含有C=C的有机物与O3作用形成不稳定的臭氧化物,臭氧化物在还原剂存在下,与水作用分解为羰基化合物,总反应为: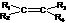
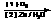
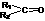 +
+ (R1、R2、R3、R4为H或烷基)。以下四种物质发生上述反应,所得产物为纯净物且能发生银镜反应的是
(R1、R2、R3、R4为H或烷基)。以下四种物质发生上述反应,所得产物为纯净物且能发生银镜反应的是
A、(CH3)2C=C(CH3)2 B、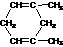 C、
C、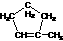 D、
D、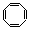 (环辛四烯)
(环辛四烯)
5.醛类(R-CHO)分子中羰基上氧原子吸引电子能力强于碳原子,使羰基碳上带有部分正电荷,从而表现出以下两方面的性质:
①碳基碳接受带负电荷或带部分负电荷的原子或原子团进攻,而发生加成反应,称为亲核加成反应。
②α-氢(R-CH2-CHO)表现出一定酸性,能与碱作用,产生碳负离子:R--CH-CHO。
(1)醛与亚硫酸氢钠加成反应的过程如下:
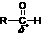 +
+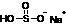

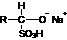 (I)
(I)
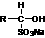 (II)
(II)
为什么(I)会转化成(II)?
(2)已知R-CH2-CHO+NH2-NH2 A
A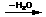 R-CH2-CH=N-NH2,写出A的结构简式。
R-CH2-CH=N-NH2,写出A的结构简式。
(3)乙醛与乙醇在催化剂作用下,可生成半缩醛(C4H10O2)和缩醛(C6H14O2)。试写出半缩醛的结构简式和缩醛的结构简式。
(4)乙醛与OH-作用可产生的碳负离子,该碳负离子又可进攻另一分子乙醛,而发生加成反应:
2CH3CHO C(分子式:C4H8O2)
C(分子式:C4H8O2)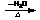 D
D
试写出该碳负离子的电子式和C、D的结构简式。
4.卤代烷可以跟金属镁反应得到有机合成很有用的格氏试剂。
RX+Mg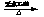 RMgX(格氏试剂,黏稠液体)
RMgX(格氏试剂,黏稠液体)
格氏试剂可以跟醛酮的羰基起加成反应,羰基加在碳基碳原子上,得到的镁盐水解后生成相应的醇。
RMgX+

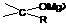

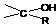
(1)某化合物A的分子式为C10H14O,具有水果香型,它由下列合成路线(下图)制得,请填写方框中化合物的结构式。


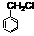
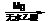



 化合物A(C10H14O)
化合物A(C10H14O)
(2)设计一个合理路线,实现由正丙醇制备正丁醇,写出各步反应的条件和产物。
(3)制备3-甲基-3-己醇可以选用3种不同的格氏试剂和3种不同的醛或酮作反应物,试写出这3对反应物。
3.类似于卤素X2与苯的同系物的反应,卤代烃亦可进行类似反应,如1,3,5-三甲苯与氟乙烷的反应。它们的反应经历了中间体(I)这一步,中间体(I)为橙色固体,熔点-150C,它是由负离子BF4-与一个六元环的正离子组成的,正离子中正电荷平均分配在除划*号碳原子以外的另五个成环的碳原子上,见下图(II)虚线。
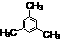 +CH3CH2F+BF3
+CH3CH2F+BF3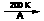
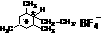 (I)
(I)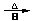
 (II)+HF+BF3
(II)+HF+BF3
(1)从反应类型看,反应A属于_______,反应B属于________,全过程属于_________。
(2)中间体(I)中画*号的碳原子的立体构型与下列化合物中画*号碳原子接近的是
A、*CH≡CH B、CH3*CH2CH3 C、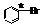 D、
D、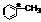
(3)模仿上题,完成下列反应(不必写中间体,不考虑反应条件,但要求配平)。
①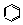 +CH3COCl
+CH3COCl
②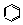 (过量)+CHCl3
(过量)+CHCl3
③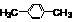 +
+

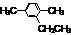 +HBr
+HBr
2.阳离子交换树脂有很多,如磺酸型阳离子交换树脂,它是由交联的聚苯乙烯磺化而得,磺酸基为强酸性。其H+可以与水中的阳离子发生交换作用而除去水中的阳离子。又知:高分子化合物分线型和体型两种,其中体型分子时交联的。
(1)交联的聚苯乙烯中高分子链之间由某种结构以化学键相联。请你选择一种合适的化学物与苯乙烯共聚合(不需溶剂),以得到交联的聚苯乙烯,这种化合物是什么?
(2)不同用途要求交联的程度不同,如何控制交联的程度?
(3)用离子交换树脂可以制备纯水(去离子水)。自来水与磺酸型离子交换树脂交换作用后显什么性?是中性,碱性还是酸性?为什么?
(4)与此类似,季铵碱(-NR3OH)型离子交换树脂可以交换水中的阴离子,中性的自来水经交换除去阴、阳离子后显什么性?是酸性、中性,还是碱性?
1.用CO和H2在443K~473K温度下,并用钻(Co)作催化剂,可以反应生成n=5~8的烷烃,这是人工合成汽油的方法之一。
(1)写出用CnH2n+2表示的人工合成汽油的配平的化学方程式;
(2)如果向密闭的合成塔内通入恰好能完全反应的CO和H2,当完全反应后,合成塔内温度不变,而塔内气体压强降低到原来的2/5,通过计算说明这时有无汽油生成。
(3)要达到上述合成汽油的要求,CO和H2的体积比的取值范围为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com