
题目列表(包括答案和解析)
2.燃料电池
燃料电池的能量转化率(化学能转化为电能)较高。在燃料电池中,电解质可以是固体电解质,也可以是液体电解质。在通常的情况下,电解质为碱性溶液,且参与负极反应。一般情况下,燃料电池的电池反应与该燃料燃烧的化学反应有时相同,有时不同。如:
①氢氧燃料电池(电解质为KOH溶液)
负极反应:
正极反应:
电池反应:
②甲烷燃料电池(电解质KOH溶液)
负极反应:
正极反应:
电池反应:
③熔融盐燃料电池具有高的发电效率,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在6500C下工作的燃料电池。
负极反应:
正极反应:
电池反应:
1.原电池和电解池
原电池的负极是电极材料较活泼的金属,正极是电极材料较不活泼的金属。注意:这里的“活泼或不活泼”是相对的,判断时要与电解质溶液联系起来。同时,要注意的是:正极材料不一定要是金属,有是其他材料也可以。如酸性解质中,Mg比Al活泼,因此Mg为负极,Al为正极;而在碱性介质中,Al比Mg活泼,因此Al为负极,Mg为正极。
电解池要注意阳极材料。若阳极材料是石墨或Pt,则为惰性电极,因此阳极反应肯定是电解质溶液中的阴离子迁移到阳极放电。若阳极材料为石墨和Pt以外的金属,则该金属一定失去电子,发生氧化反应。我们不必理会该金属是排在氢元素前的金属还是排在氢元素后的金属。若阳极是铁,失去电子得Fe2+。
注意:书写电极反应时,最好是正极和负极得失电子数相等。
9.水是生命之源。目前,我国人均用水量仅为世界人均用水量的30%,已被联合国列为世界上13个最缺水的国家之一,因此,我们既要节约用水,又要对污水进行必要的净化处理,以防污染环境。常用的无机类净水剂有:铁盐、亚铁盐、铝盐、锌盐。用于制造白纸的水,使用的净水剂不能是__________,原因是__________;为解决水危机,人们急需把海水转化为淡水,其中的一种方法是:使海水按顺序通过两种离子交换剂,其流程如图所示。现有氢型阳离子交换树脂HR(类似于磺化煤NaR)和羟型阴离子交换树脂ROH,A柱应装填__________交换树脂,B柱应装填__________交换树脂,原因是__________。
8.MgCl2·6CH3OH、CaCl2·4C2H5OH、CaCl2·4CH3OH之类的化合物称结晶醇。结晶醇易溶于水,不溶于有机溶剂。利用结晶醇的知识,设计一个在乙醚中除去混杂的少量乙醇的方法(指要求写过程和原理)。

7.环境监测测定水中溶解O2的方法是:
量取a mL水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,震荡使反应均匀。开塞,迅速加入适量的硫酸,此时有I2生成。用Na2S2O3溶液(浓度为b mol/L)和I2反应,消耗了V mL(以淀粉为指示剂)。有关反应方程式为:
2Mn2++O2+4OH- 2MnO(OH)2(反应很快)
2MnO(OH)2(反应很快)
MnO(OH)2+2I-+4H+ Mn2++I2+3H2O
Mn2++I2+3H2O
I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
(1)水中溶解氧的量(以mg/L O2为单位)为___________________。
(2)I2和S2O32-反应为淀粉指示剂,达到终点的颜色如何变化?
(3)加MnSO4及含有KI的NaOH溶液后震荡时,若塞子未塞紧(设振荡时未溅出溶液)测定结果将比(1)高或低或和(1)相同?说明理由。
(4)开塞到加硫酸前的时间间隔很长,结果比(1)高或低或和(1)相同?说明理由。
6.请你用最简单的方法证明一个鸡蛋是生鸡蛋还是熟鸡蛋。简述理由。
5.将50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:(i)用25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;(ii)小心煮沸溶液1~2分钟;(iii)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2CO3?________。理由是_______________________。
(2)按他的设计,第(i)步实验装置如下:
①
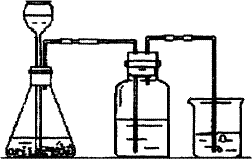 装置A使用的试剂是石灰石和盐酸溶
装置A使用的试剂是石灰石和盐酸溶
液。可否使用纯碱代替石灰石?________。
原因是____________________________。
②装置B使用的试剂是___________,
作用是____________________________。
③为了便于后续实验的煮沸、混合等操
作,装NaOH溶液的容器还可使用______。
(填实验仪器)
④有人认为实验步骤(ii)、(iii)的顺序对调, A B 25mL NaOH溶液
即先混合,再煮沸,更合理,你认为对吗?_________,为什么?__________________。
4.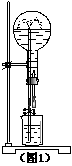 喷泉是一种常见的自然现象,其产生原因是存在压强差。
喷泉是一种常见的自然现象,其产生原因是存在压强差。
(1)(图1)为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体,下列物质组合中,不可能形成喷泉的是__________。
A.HCl和H2O B.O2和H2O
C.NH3和H2O D.CO2和NaOH溶液。
(2)某同学积极思考产生喷泉的其他办法,并设计了如(图2)所示的装置。
①在图2的锥形瓶中,分别加入足量的下列物质组,反应后也可以产生喷泉的是__________。
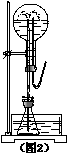 A.Cu与稀盐酸 B.NaHCO3和NaOH溶液
A.Cu与稀盐酸 B.NaHCO3和NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
②将图2的锥形瓶浸入一水槽,瓶中加入酒精,水槽中加入冷水后,于水槽中加入足量的下列物质,同样也产生了喷泉。在水槽中加入的物质可以是__________。
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜。
(3)如果不用上面第(1)、(2)小题中已谈到的反应和物质,利用右图1或图2仪器,请你另外设计一种能进行喷泉实验的方法(简要说明要使用的试剂和原理,不必说操作方法):__________。
3.某学生作铜片和浓硝酸实验。他从实验台上取一瓶曾启用过的浓硝酸做实验。实验完毕后,他又重新取一瓶未开封、避光保存的浓硝酸(分析纯)作实验。结果发现:开始时铜和浓硝酸几乎不作用,较长时间后,二者才激烈反应。他对此迷惑不解。请你为他做出合理的解释,并设法验证你的解释。
2.为了打击市场上假冒含碘盐,请你设计一种试纸,可以方便地检验市场上出售的盐是否含碘, 简述用试纸检验的操作过程(设含碘盐为NaCl中加入了NaIO3)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com