
题目列表(包括答案和解析)
7.科学家预言,燃料电池将成为20世纪获得电力的重要途径。因为燃料电池有很多的优点。它的能量转化率比火力发电高一倍多,环境污染少,节能。按燃料电池化学成分的不同,有氢、一氧化碳、联氨、醇和烃等类型;按电解液的性质不同,可分为碱性、酸性、熔盐和固体电解质、高聚物电解质、离子交换膜等类型。
以渗透于多孔基质惰性导电物材料为电极,用35%~50%KOH为电解液,天然气和空气为原料,构成的电池为碱性燃料电池。请写出:
负极反应:___________;正极反应:___________;电池总反应式:___________。
用两种或多种碳酸盐的低熔点混合物为电解质,例如Li2CO3 52%、Na2CO3 48%,采用吸渗锦粉作阴极,多孔性氧化镁作阳极,以含一氧化碳为主要成分的阳极燃料气,混有CO2的空气为阴极燃气,在6500C电池中发生电极反应,这种电池在国外已经问世。请写出有关的反应式。
负极反应:___________;正极反应:___________;电池总反应式:___________。
6.把两个用导线联接的铁电极放入到没有空气的溶液中,当在其中一个电极上通入氧气则发现另一个电极开始溶解,且导线上有电流通过,而通氧气的电极周围的溶液变成了碱性。试解释这一现象,写出电极反应式,画出电池图并标出阴极、阳极及电子流动的方向。
5.市场上出售的一种热敷袋中的主要成分是铁屑、炭粉、木屑和少量食盐水等。热敷袋在启用之前在包袋的透气材料袋外用一个不透气的塑料袋密封。使用时打开外边的塑料袋的口部,用手轻揉,不久就发热,即可进行热敷。使用后会发现袋里的物质出现大量的铁锈。试回答:
(1)这种热敷袋中有关发出热量的原理是什么?
(2)写出有关的致热的电极反应方程式,并标明在何处发生这些反应。
4.称取三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上导管塞子,定时间测定生成H2的体积。甲加入50mL、pH=3的盐酸,乙加入50mL、pH=3的醋酸,丙加入50mL、pH=3的醋酸及少量胆矾粉末。若反应终了,生成的H2一样多,且无剩余的锌。请用“>”、“=”、“<”回答:
(1)开始时反应速率的大小为____________;
(2)三支试管中参加反应的锌的质量为____________;
(3)反应终了,所需的时间为____________;
(4)在反应过程中,乙、丙速率不同的理由是____________。
3. 如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝氧化及两球的浮力变化)
如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝氧化及两球的浮力变化)
A、杠杆为导体和绝缘体时,均为A端高B端低
B、杠杆为导体和绝缘体时,均为A端低B端高
C、当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D、当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
2.下列叙述正确的是
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜能加快反应速率
②锌层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电镀槽的阴极
④冶炼铝时,把氧化铝加入液态冰晶石中成为熔融体后电解
⑤钢铁表面常易锈蚀生成Fe2O3·nH2O
A ①②③④⑤ B ①③④⑤ C ①③⑤ D ②④
1.如图所示:
若容器中盛有稀硫酸溶液,则原电池的正极是_____________,负极是______;其电极反应为:_____________;电池反应为_______________;若容器中加入NaOH溶液,则原电池的正极是__________,负极是____________;其电极反应为_______________________;电池反应为__________________________;由此得出的判断原电池正、负极的结论是______________。如何用实验方法论证你的结论?
(2008复旦)铅蓄电池放电反应Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
下列判断正确的是
A、PbO2是氧化剂 B、Pb是氧化剂
C、Pb是正极 D、PbO2是负极
(2004年交大)试写出Cu2+与I-反应离子方程式。从氧化还原反应的原理和原电池的概念出发,该反应中可以充当原电池正极的物质是___________,充当负极的物质是_______________;
(2008武大)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A、4Fe(OH)2+2H2O+O2 4Fe(OH)3↓ B、2Fe+2H2O+O2
4Fe(OH)3↓ B、2Fe+2H2O+O2 2Fe(OH)2↓
2Fe(OH)2↓
C、2H2O+O2+4e 4OH-
D、Fe-3e
4OH-
D、Fe-3e Fe3+
Fe3+
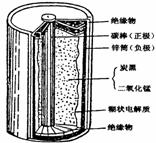 (2008厦大)某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质。整个实验过程如下,请回答有关问题:
(2008厦大)某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质。整个实验过程如下,请回答有关问题:
(1)干电池的基本构造和工作原理。
干电池的外壳是金属锌,作负极,中心碳棒(石墨)是正极,碳棒周围由一层纸质包裹的黑色物质,这是石墨粉和二氧化锰的混合物,纸质和锌壳之间填满了糊状白色电解液,其成分是氯化铵、氯化锌和淀粉糊。
右图为干电池的基本构造图。干电池工作时负极上的电极反应式是______________。
正极上的电极反应式是__________________(已知NH4+的得电子能力大于Zn2+)。MnO2作去极剂(吸收正极放出的H2,防止产生极化现象),该反应方程式为:H2+2MnO2 Mn2O3+H2O。而淀粉糊的作用是提高阴、阳离子在两个电极的迁移速率。
Mn2O3+H2O。而淀粉糊的作用是提高阴、阳离子在两个电极的迁移速率。
正极产生的NH3又和ZnCl2溶液作用:Zn2++4NH3 [Zn(NH3)4]2+
[Zn(NH3)4]2+
(2)锌皮和碳棒的回收。
用钳子和剪刀剪开回收的干电池的锌铜,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离。
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤。
②设计简单的实验证明所得晶体中含有NH4+。
实验步骤:______________。实验现象:______________。有关的离子方程式:______________。
③用什么方法可将NH4Cl和ZnCl2的晶体混合物分离开?
(4)最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器有______________。
4.原电池的应用
(1)制造各种各样的电池:
在现代生活、生产和科学技术的发展中,电池发挥着越来越重要的作用,如大至宇宙火箭、人造卫星、空间电视转播站、飞机、轮船,小至电脑、收音机、照相机、电话、助听器、电子手表、心脏起搏器等,都离不开各式各样的电池。
(2)应用于金属的防腐-电化学保护法
①外加电流的阴极保护法
金属氧化生成的电子流跟外加电流的方向是相反的。只要外加足够强的电压,金属腐蚀而产生的原电池电流就不能被输送,因而腐蚀也就不能发生。根据这种防护原理,要保护的金属是在阴极。因此,这种方法叫做外加电流的阴极保护法。例如,对钢闸门采取涂料和外加电流的联合防腐的新方法,就可以收到明显的效果。
②牺牲阳极的阴极保护法
牺牲阳极的阴极保护法是在要保护的钢铁设备上联结一种更易失去电子的金属或合金。如右图所示,钢闸门的保护,有的就应用这种方法。它是用一种比铁更为活泼的金属,如锌等,联结在钢闸门上。这样,当发生电化腐蚀时,被腐蚀的是那种比铁活泼的金属,而铁被保护了。通常在轮船的尾部和在船壳的水线以下部分,装上一定数量的锌决,来防止船壳等的腐蚀,就是应用的这种方法。
(3)应用原电池原理,可以加快化学反应
如纯锌与硫酸反应较慢,可以往反应体系中加入几滴CuSO4溶液,以加快反应。其原理是:Zn与CuSO4溶液反应:Zn+CuSO4 Cu+ZnSO4,这样Zn与Cu在电解质溶液中组成了Cu-Zn原电池,加快了反应。请同学们思考:如何降低粗锌与硫酸的反应速率呢?
Cu+ZnSO4,这样Zn与Cu在电解质溶液中组成了Cu-Zn原电池,加快了反应。请同学们思考:如何降低粗锌与硫酸的反应速率呢?
3.法拉第电解定律
法拉第电解定律反映了通电电量与电解析出物质的质量的相互关系。其公式为: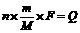 ,变形得:
,变形得: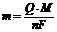 。其中,n为金属的化合价,m为电解时溶解或析出的质量;M为金属的摩尔质量;F为法拉第常数(即1mol电子电量);Q为电解过程中所通的电量,即Q=It(I为电路的电流强度,t为通电时间)。
。其中,n为金属的化合价,m为电解时溶解或析出的质量;M为金属的摩尔质量;F为法拉第常数(即1mol电子电量);Q为电解过程中所通的电量,即Q=It(I为电路的电流强度,t为通电时间)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com