
题目列表(包括答案和解析)
23.根据下图装置进行实验,并按要求填空。
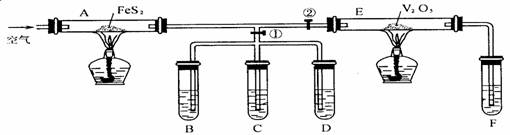
B:品红溶液 C:碘淀粉溶液 D:Ba(OH)2溶液 F:酚酞烧碱溶液
(1)通入空气,加热A处,打开①开关,关闭②开关,写出A处高温下的化学反应方程式,并指出电子转移方向和数目:________________________,将生成物通入C的现象是________________,D中的现象是__________________,离子方程式为_______________。
(2)继续通入空气加热A处,同时关闭①开关,打开②开关,并加热E处,并写出E处的化学方程式___________________,将E处产物通入F中的现象是_______________。
答案:选择题
12.甲、乙、丙三学生各设计了一个实验,结果各自都认为自己所检测的试样中含有SO42-离子。
(1)甲实验为:试样A的无色溶液 白色沉淀
白色沉淀 沉淀不溶解。
沉淀不溶解。
乙认为甲的实验不严谨,因为试样A中若含有 离子(仅填一种),也会有此现象。
(2)乙实验为:试样B的无色溶液 白色沉淀
白色沉淀 沉淀不溶解。
沉淀不溶解。
丙认为乙的实验也不严谨,因为试样B中若含有 离子(仅填一种),也会有此现象。
(3)丙实验为:试样C的无色溶液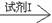 现象I
现象I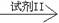 现象II。
现象II。
若丙方案实验后公认为合理,则回答:试剂I是 ,实验中必须加至 ,此时的现象I是 ;试剂II是 ,此时的现象II是 。
11.针对以下A-D4个涉及H2O2的反应(未配平),填空回答:
A.Na2O2+HCl--H2O2+NaCl B.Ag2O+H2O2--Ag+O2+H2O
C.H2O2 △ H2O+O2 D.H2O2+Cr2(SO4)3+KOH--K2CrO4+K2SO4+H2O
(1)H2O2仅表现氧化性的反应是(填代号),____________该反应配平的化学方程式为
。
(2)H2O2既表现氧化性又表现还原性的反应是(填代号) 。
(3)H2O2表现弱酸性的反应是_________,其理由为 。
10.有一瓶无色气体可能含有CO2、HBr、HCl、SO2中的一种或几种。将其通入稀氯水中,恰好完全反应,得到无色透明溶液。把溶液分成两份,向其中一份加入AgNO3溶液(用稀硝酸酸化)生成白色沉淀,向另一份加入BaCl2溶液(用盐酸酸化)也生成白色沉淀。以下结论正确的是( )
A.原气体中肯定有SO2 B.原气体中肯定有HCl
C.原气体中肯定无CO2 D.原气体中肯定没有HBr
9.下列反应的离子方程式中,错误的是( )
A.将SO2通入Ca(ClO)2溶液:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B.用氨水吸收少量的二氧化硫气体:2NH3·H2O+SO2=2NH4++SO32-+H2O
C.Cl2通入Na2SO3溶液中:Cl2+SO32-+H2O=2H++SO42-+2Cl-
D.硫酸氢钠溶液与氢氧化钡溶液等物质的量混合:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O
8.mg纯铜粉与足量浓硫酸反应,得到VL二氧化硫气体(标况),则被还原的硫酸为( )
A.m/64mol B.m/32mol C.98V/22.4g D.64m/22.4g
7.第三周期元素R,它的原子核外最外层上达到饱和所需电子数得最内层电子数的正整倍,且小于次外层电子数的3/4。则关于R的正确判断是( )
A.常温下能稳定存在的R的氧化物都能与烧碱溶液反应
B.R的单质的熔沸点都很低 C.R的最高价氧化物的水化物均显酸性
D.R的气态氢化物在常温下都能稳定存在
6.已知①2H2S + SO2 == 3S↓+ 2H2O ② S + 2H2SO4(浓)== 3SO2↑+ 2H2O
③ 3S + 6KOH == 2K2S + K2SO3 + 3 H2O 则下列说法正确的是( )
A.①说明能与酸反应,SO2具有碱性氧化物的通性
B.②改用稀硫酸,则放出H2 C.②和③说明硫具有两性元素的性质
D.上述反应说明硫既有氧化性又有还原性
5.一定量的锌与100 mL 18.5 mol·L-1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6 L。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1。则生成的气体中SO2和H2的体积比为( )
A.1:2 B.2:1 C.1:4 D.4:1
4.工业上从含硒的废料中提取硒的方法之一是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸,加入盐酸共热,硒酸被转化为亚硒酸,2HCl + H2SeO4 == H2SeO3 + Cl2↑ + H2O,再将SO2通入亚硒酸的溶液中,单质硒即析出。据此下列叙述正确的是( )
A.H2SeO4氧化性弱于Cl2 B.二氧化硫的还原性强于Se
C.亚硒酸的氧化性强于硫酸 D.析出1molSe需H2SeO3、SO2、H2O各1mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com