
题目列表(包括答案和解析)
15.A、B、C、D四种元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_______________元素,B为_______________元素;C为_______________元素。D的质子数和中子数相等,D的原子组成符号为_____________,它的最高价为___________价。
(2)用电子式表示A、D两元素形成AD2的过程:______________________________,用电子式表示C、D两元素形成化学键的过程:______________________________。
(3)写出E和A的最高价氧化物反应的化学方程式:________________________________。
解析:B、C离子具有相同的电子层结构,且生成淡黄色固体,则B是氧,C是钠。A原子序数小于氧,且最外层有4个电子,则A是碳,D是硫。
答案:(1)碳 氧 钠 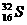 +6
+6
(2) 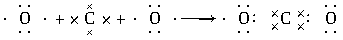

(3)2Na2O2+2CO2====2Na2CO3+O2
14.对于放热反应2H2+O2====2H2O,下列说法正确的是( )
A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D.反应物H2和O2具有的能量相等
解析:放热反应指反应物所具有的总能量高于生成物所具有的总能量,在发生化学反应时,有一部分能量转化成热能释放出来。
答案:B
13.A、B、C、D、E五种元素从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:
|
A |
B |
C |
D |
E |
下列说法正确的是( )
A.E元素的最高化合价为+7时,D元素的负化合价可为-2
B.A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
解析:E元素的最高化合价为+7时,D元素的最高化合价必为+6,则D元素的负化合价可为-2。A(OH)n为强碱时,B(OH)m可能为强碱,也可能为中强碱,还可能为弱碱。HnDOm为强酸,即D元素的非金属性很强,原子序数比D大1的E可能为非金属性比D强的非金属元素,也可能为稀有气体元素。元素C与元素E的关系可这样举例,如:C是16S,E是18 Ar;C是17Cl,则E是19K。
答案:AD
12.锌片与盐酸的反应属于( )
A.吸热反应 B.放热反应
C.既是吸热反应又是放热反应 D.都不是
解析:金属与酸的反应都是放热反应。
答案:B
11.下列分子的电子式书写正确的是( )
A.氨气 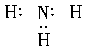
B.四氯化碳 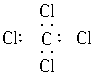
C.氮气 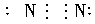
D.二氧化碳 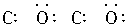
解析:在书写共价分子的电子式时,应注意:①各原子最外层的电子即使未参与成键也必须全数标出;②要正确标出共用电子对的对数;③较复杂的分子要标对原子间的连接方式,原子间的连接方式不一定是分子式书写的顺序。如HClO的排列顺序为HOCl, 而不是HClO。A项中N原子的最外层电子没有全部标出;B项中Cl原子的最外层电子也没有全部标出;D项中C、O共用电子对数标错,也不满足8e-稳定结构,正确写法为:
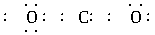 。
。
答案:C
10.已知X、Y均为1-18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则这两种元素的原子序数之和为( )
A.19 B.18 C.16 D.9
解析:根据以往知识,符合X2Y和X2Y2形式的分子式有Na2O、Na2O2和H2O、H2O2两组,但第二组不符合Y的原子序数小于X的原子序数的条件,第一组不仅符合,而且选项中有。
答案:A
9.周期表中关于主族元素性质的叙述不正确的是( )
A.主族序数等于原子最外层电子数
B.主族元素最高正价等于最外层电子数
C.第n主族元素的最高正价为+n,负价绝对值为8-n(n≥4)
D.第n主族元素的最高价氧化物分子式为R2On,氢化物分子式为RHn(n≥4)
解析:对于主族元素,其主族序数等于最外层电子数,也等于其最高正化合价,且最高正化合价与最低负化合价的绝对值相加等于8,故A、B、C项都正确。D项中最高价氧化物分子式是R2On,但其氢化物的分子式为RH8-n。
答案:D
8.在海湾战争期间,科威特大批油井爆炸着火。在灭火工作中,下列措施不能考虑用于灭火的是( )
A.设法阻止石油喷射 B.设法降低火焰温度
C.设法降低石油着火点 D.设法使火焰隔绝空气
解析:物质的着火点是固定的,是由物质的本质决定的,不能降低。故选C。
答案:C
7.关于锂的结构和性质的判断,错误的是( )
①与水反应比钠剧烈 ②密度比钠小 ③氧化物暴露于空气中易吸收CO2 ④阳离子最外层电子数和钠的相同 ⑤是还原剂
A.只有① B.③和⑤ C.②和③ D.①和④
解析:碱金属随着核电荷数的递增,金属活泼性增强,故①错。Li+最外层只有2个电子,故④错。
答案:D
6.砹(At)是核电荷数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是( )
A.砹化氢(HAt)很稳定 B.砹易溶于某些有机溶剂
C.砹是有色固体 D.AgAt不溶于水,NaAt的熔点较高
解析:卤素氢化物的稳定性是随着非金属活泼性增强而递增的,氟的非金属性最强,所以氟化氢最稳定。砹的活泼性较F、Cl、Br、I都差,其氢化物应该不如碘化氢稳定。卤素单质有易溶于某些有机溶剂的特性,砹为卤素,其单质也应易溶于某些有机溶剂。卤素单质氟、氯、溴、碘均有颜色,砹单质也必然有颜色。卤素单质随相对分子质量递增熔沸点递增。氟、氯单质为气态,溴单质为液态,碘单质为固态,砹是比碘相对分子质量还大的卤素,肯定为固态。AgCl、AgBr、AgI均为不溶于水的固体,依次可推知AgAt也不溶于水。NaCl、NaBr、NaI等卤素的碱金属盐都属于离子晶体,NaAt也属于离子晶体,因此有较高的熔沸点。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com