
题目列表(包括答案和解析)
2.关于苯的下列说法正确的是( )
A.苯分子是环状结构,其性质跟环烷烃相似
B.  表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同
表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同
C.苯的分子式是C6H6,分子式中的碳原子远没有饱和,因此能使溴水褪色
D.苯环上的碳碳键是一种介于单键和双键的独特的键,因此苯易发生取代反应而难发生加成反应
解析:苯分子结构中的碳碳键既不是单键也不是双键,它是介于二者之间的一种特殊的化学鍵。
答案:D
1.能用于鉴别CH3-CH3和C2H4的试剂是( )
A.溴水 B.KMnO4(H+) C.NaOH溶液 D.CCl4
解析:C2H4因含有碳碳双键能使溴水和高锰酸钾酸性溶液褪色。
答案:AB
4.已知甲苯(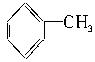 )苯环上的二氯取代物有六种,则甲苯苯环上的三氯取代物有____种。
)苯环上的二氯取代物有六种,则甲苯苯环上的三氯取代物有____种。
解析:甲苯苯环上被两个氯取代后,苯环上还有三个可被取代的氢原子。当两个氯原子在苯环上排列的同时,苯环上的三个氢原子也在进行着相应的排列,这是一种隐含性变化,认识了它,也就掌握了该题的解题技巧、捷径。
答案:6
10分钟训练(强化类训练,可用于课中)
3.下列有关苯的分子结构与化学性质的事实,无法用凯库勒结构式解释的是( )
①呈六角环状结构 ②能发生加成反应 ③不能使高锰酸钾酸性溶液褪色 ④不能与溴水反应而使溴水褪色 ⑤分子中各分子间的键长都相等 ⑥分子中各C-H键长相等
A.①②⑥ B.③④⑤ C.①②④⑥ D.全部
解析:凯库勒结构式是单双键相间的结构,与苯的实际结构不符。
答案:B
2.下列物质不可能是乙烯加成产物的是( )
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
解析:乙烯能与H2、HCl、H2O和HBr等加成分别生成CH3CH3、CH3CH2Cl、CH3CH2OH和CH3CH2Br,故不可能生成CH3CHCl2,因为2个Cl不可能加成在一个C原子上。
答案:B
1.关于乙烯的用途的有关说法不正确的是( )
A.制塑料 B.生产有机溶剂 C.常作气体燃料 D.作果实催熟剂
解析:乙烯是一种重要的化工原料,通常用来衡量一个国家石油化工发展水平的标志,可以用来制造塑料、生产有机溶剂和果实催熟剂,一般不用作燃料。
答案:C
15.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_______________。产物中的单质B是______________。
(2)②中所发生反应的反应的化学方程式是_________________________________________。
(3)③中所发生的各反应的离子方程式是___________________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________________________,c(Fe2+)为___________________________。
解析:MgO不能与铝发生置换反应,所以①发生的反应是Fe2O3+2Al 2Fe+Al2O3。
2Fe+Al2O3。
②中发生的反应是Fe2O3+6HCl====2FeCl3+3H2O,MgO+2HCl====MgCl2+H2O。
③中发生的反应是Fe+2FeCl3====3FeCl2,Fe+2HCl====FeCl2+H2↑。
④中加入KSCN溶液不变色,说明Fe3+完全被还原为Fe2+,溶液D为MgCl2、FeCl2的混合液。根据题意假设20 g A中MgO和Fe2O3的物质的量均为x,则:40 g·mol-1x+160 g·mol-1x=20 g,解得x=0.1 mol。
溶液中Mg2+的物质的量等于MgO的物质的量,c(Mg2+)=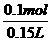 =0.67 mol·L-1。
=0.67 mol·L-1。
反应后原加入的盐酸中的Cl-全部转移到FeCl2和MgCl2中,Cl-守恒,所以溶液D中
n(Cl-)=n(Mg2+)×2+n(Fe2+)×2=6.0 mol·L-1×0.15 L=0.9 mol
n(Fe2+)= =0.35 mol
=0.35 mol
所以c(Fe2+)= =2.3 mol·L-1
=2.3 mol·L-1
答案:(1)加少量KClO3,点燃镁条并将其倒插在混合物上 Fe
(2)Fe2O3+6HCl====2FeCl3+3H2O,MgO+2HCl====MgCl2+H2O
(3)Fe+2H+====Fe2++H2↑,Fe+2Fe3+====3Fe2+
(4)0.67 mol·L-1 2.3 mol·L-1
14.2010年6月5日世界环境日。深圳及周边沿海城市海域赤潮现象日益严重,导致鱼类大量死亡,可见,海洋保护环境刻不容缓。在海水中溴以溴化镁和溴化钠的形式存在。经过晒盐和氯化钾后的卤水中,溴的含量已提高100倍左右。只要把卤水加入反应塔中,通过氯气(1)和水蒸气蒸馏,就可以把“溴”蒸出来(2),也有借助煤油从海水中提溴的(3),煤油用过之后还可以回收(4)。土法提溴可用盐酸作用于漂白粉(5)或用二氧化锰氧化盐酸制取氯。
请完成以下几个问题:
(1)写出卤水中通入氯气时发生反应的离子方程式。______________________________。
(2)为什么通过蒸馏法就可以将溴蒸出来?______________________________________。
(3)用煤油提取溴的方法叫______________________________,煤油能作溴的萃取剂的原因是______________________________,如何分离海水和溴的煤油溶液?__________________。
(4)如何分离溴和煤油?_________________________________________________________。
(5)漂白粉的主要成分是_______________,其中能与浓盐酸反应的是_______________,它跟盐酸反应的化学方程式为_____________________________________________,这是一个氧化还原反应,其中氧化剂是_______________,盐酸表现_______________性。
解析:海洋提炼溴的方法是首先将海水浓缩,然后加入合适的氧化剂将溴离子氧化成溴单质,因为溴易挥发且易溶于有机溶剂,所以可以利用萃取法或蒸馏法将溴提取出来。漂白粉是氯化钙和次氯酸钙的混合物,其中有效成分为次氯酸钙,次氯酸钙中的次氯酸根具有强氧化性,能氧化浓盐酸中的氯离子生成氯气。
答案:(1)2Br-+Cl2====Br2+2Cl-
(2)溴有挥发性,且温度越高越易挥发
(3)萃取 煤油和水不互溶,且煤油溶解溴的能力比水的大 分液
(4)蒸馏
(5)氯化钙和次氯酸钙 次氯酸钙 Ca(ClO)2+4HCl====CaCl2+2Cl2↑+2H2O 次氯酸钙 还原性和酸
13.海水中有取之不尽的化学资源,从海水中可提取多种化工原料。下图是某工厂对海水资源的综合利用的示意图。
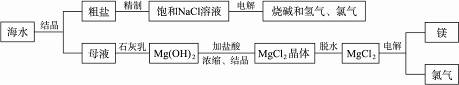
试完成下列问题:
(1)粗盐中含有Ca2+、Mg2+、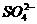 等杂质,精制后可得NaCl饱和溶液。精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液;最后加入盐酸至溶液呈中性。请写出加入盐酸后可能发生的化学反应的离子方程式为______________________。
等杂质,精制后可得NaCl饱和溶液。精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液;最后加入盐酸至溶液呈中性。请写出加入盐酸后可能发生的化学反应的离子方程式为______________________。
(2)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液里加入石灰乳起的作用是_________________________________________________________。
(3)海水里的镁元素处于游离态还是化合态?________________,从海水中提取氯化镁的反应是不是氧化还原反应?_______________,用电解法冶炼金属镁的反应是不是氧化还原反应?_______________,原因是______________________________________________________。
(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁。请思考镁蒸气可以在下列哪种气体氛围中冷却_______________。
A.H2 B.CO2 C.空气 D.O2
解析:粗盐提纯的主要过程是:过量BaCl2(沉淀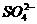 ),过量NaOH(沉淀Mg2+),过量Na2CO3(沉淀Ca2+、Ba2+),适量HCl(中和Na2CO3并调节pH)。
),过量NaOH(沉淀Mg2+),过量Na2CO3(沉淀Ca2+、Ba2+),适量HCl(中和Na2CO3并调节pH)。
答案:(1)OH-+H+====H2O CO2-3+2H+====H2O+CO2↑
(2)将Mg2+沉淀为Mg(OH)2
(3)化合态 不是 是 发生了化合价的变化
(4)A
12.将两张圆形滤纸分别折叠成漏斗状,套在一起使四周都是四层,把内层“纸漏斗”取出,在底部剪一个孔,用水湿润,再与另一“纸漏斗”套在一起,架在铁架台铁圈上,下面放有盛有细沙的蒸发皿,将5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在“纸漏斗”中,上面加少量氯酸钾,并在混合物中插一根镁条,用燃着的木条点燃镁条。完成下列问题:
(1)上述反应的实验现象为____________________________________________________,因此铝可用于制造信号弹、燃烧弹、火箭推进剂等。
(2)上述反应的化学方程式为:________________________________________________,此反应称为铝热反应,铝粉和氧化铁粉末的混合物称为铝热剂,铝热反应可用于焊接铁轨。铝粉可以和铁、铬、锰的氧化物粉末发生铝热反应,铝变成氧化铝,铁、铬、锰等金属的氧化物变成相应的金属单质。写出下面反应的方程式。
Al+MnO2_____________________________________________________________________;
Al+Fe2O3____________________________________________________________________;
Al+Cr2O3____________________________________________________________________。
解析:铝与氧化物反应的实质是氧化还原反应,铝将氧化物中的化合态金属元素还原为金属单质。反应的特点是在高温下进行,反应迅速并放出大量的热,新生成的金属单质呈液态且易与Al2O3分离。反应的重要意义:一是焊接钢轨,二是冶炼V、Cr、Mn等难熔的金属。
做该实验时,要注意以下几点:
①镁条要打磨净表面的氧化膜,否则难以点燃。Al2O3与Al粉要干燥,Al粉要用未被氧化的,否则难以反应。
②Fe2O3与Al质量比要控制在3∶1,且二者要混合均匀,以保证Fe2O3与Al都完全反应。
③玻璃漏斗内的纸漏斗要厚,并要用水润湿,以免损伤玻璃漏斗。
④承接反应物的蒸发皿内要垫适量的细砂,一是防止蒸发皿炸裂,二是防止熔融的固体溅出伤人。
⑤实验装置不要离人群太近,或将实验在通风橱内损伤,防止人受伤。
答案:(1)当外部镁条刚刚燃烧完毕时,纸漏斗内混合物立即剧烈反应,发出耀眼的白光,产生大量的烟。纸漏斗被烧破,有红热状态的液珠落入蒸发皿内的细沙上。液珠冷却后变为黑色固体
(2)2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
4Al+3MnO2 2Al2O3+3Mn
2Al2O3+3Mn
2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
2Al+Cr2O3 Al2O3+2Cr
Al2O3+2Cr
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com