
题目列表(包括答案和解析)
1.下列叙述正确的是( )
A.核外电子排布完全相同的两种粒子的化学性质一定相同
B.单原子形成的离子一定具有稀有气体元素原子的核外电子排布
C.核外电子排布相同的两种原子一定属于同种元素
D.不存在质子数和电子数都相同的阳离子和阴离子
解析:本题主要是通过粒子的核外电子排布来强化对质子和电子的数量关系的认识,并熟练掌握核外电子排布相同的原子、阴离子、阳离子的本质联系。核外电子排布完全相同的两种粒子可能是原子、阴离子、阳离子三种情况中的一种或者几种,如果是同一元素的两种核素,化学性质应该相同,如果不是同一元素的两种核素,其他符合题目要求的两种粒子的化学性质肯定不同,并且有的悬殊还很大,所以A选项是错误的;我们熟悉的元素的单原子形成的离子一般具有稀有气体元素原子的核外电子排布,但也有特例,如H+核外电子数是0,不存在电子数为0的稀有气体元素的原子,所以B选项是错误的;核外电子排布相同即电子数相同,又因为都是原子,所以质子数也相同,质子数相同的不同原子必定是同位素关系,所以C选项是正确的;如果阴、阳离子的电子数相同,则其质子数必定不同,反之亦然,所以不存在质子数和电子数分别相同的阳离子和阴离子,D选项也是正确的。
答案:CD
3.在1-20号元素中(稀有气体除外),按要求用化学符号或用化学方程式完成下列问题:
(1)原子半径最小的是_________________,半径最大的是_________________。
(2)与水反应最剧烈的金属单质是__________;与水反应最剧烈的非金属单质是__________。
答案:(1)H K
(2)K F2
10分钟训练(强化类训练,可用于课中)
2.十九世纪中叶,门捷列夫总结了如图所示的元素化学性质的变化状况。

试完成下列问题:
(1)门捷列夫的突出贡献是___________________________________________________。
(2)图中变化表明( )
A.事物的性质总是在不断变化的
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.ⅠA族元素的金属性肯定比ⅡA族元素的金属性强
D.量变到一定程度必然引起质变
(3)从ⅢA族的硼到ⅦA族的砹连成一条斜线,即为金属和非金属的分界线,从分界线附近可以找到( )
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
解析:(1)门捷列夫的突出贡献是发现了元素周期律,并根据元素周期律排出了第一张元素周期表。通过对化学史知识的了解,培养我们严谨的科学态度。
(2)借助于题图所示,应明白氦是稀有气体元素,性质稳定。而ⅠA族的Li、Na的金属性比ⅡA族的Ca弱。随着原子序数的递增,同一横行由金属元素过渡到非金属元素,如题图中Al变化到Si;同一纵行由非金属元素过渡到金属元素,如题图中As变化到Sb。因而本题借助元素周期律研究元素周期表中元素性质的变化,验证了唯物辩证法的一个基本观点:量变到一定的程度引起质变。
(3)耐高温材料和新型催化剂材料在副族元素中寻找;F、Cl、Br、I是制造新型农药的材料;金属与非金属分界线附近寻找半导体材料。
答案:(1)发现元素周期律,并绘制了第一张元素周期表
(2)D
(3)C
1.据报道,月球上有大量的3He存在。以下有关3He的说法正确的是( )
A.原子核外有两个电子层 B.核外有2个电子
C.比4He多一个电子 D.比4He少一个质子
解析:3He也是He元素中同位素的一种,原子符号为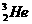 ,原子结构示意图为
,原子结构示意图为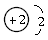 。4He也是He元素中同位素的一种,原子符号
。4He也是He元素中同位素的一种,原子符号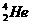 。
。
答案:B
16.氯水可以跟碘化钾溶液发生置换反应,过量的氯水还可以把碘氧化为碘酸(HIO3),化学方程式为:5Cl2+I2+6H2O====2HIO3+10HCl。碘酸是一种无色晶体,极易溶于水。现有一瓶无色溶液,其中含有Br-和I-,请用氯水、四氯化碳和试管,设计一个简单的实验,证明该无色溶液中确实含有Br-和I-,写出实验步骤和现象。
(1)___________________________________________________________________________。
(2)___________________________________________________________________________。
(3)___________________________________________________________________________。
答案:(1)取少量无色溶液于试管中,加入少量CCl4,然后逐滴加氯水,边滴边振荡,见到CCl4层中有淡紫色出现,证明原溶液中含有I-
(2)静置,分层,取上层清液于另一试管
(3)向取出的清液中加入过量氯水后,再加入CCl4,振荡,静置分层,CCl4层为橙色,证明原溶液中有Br-
15.用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色褪去,试完成下列问题:
(1)实验室保存饱和氯水的方法是_________________________________________________。
(2)产生上述现象的原因可能有两种(简要文字说明):
①是由于_____________________________________________________________________;
②是由于_____________________________________________________________________。
简述怎样用实验证明红色褪去的原因是①或者是②
_____________________________________________________________________________。
答案:(1)在阴凉处置于棕色试剂瓶中密封保存
(2)①氯水与NaOH反应生成两种盐,碱性减弱
②氯气过量后HClO的漂白性将溶液变成无色,向无色溶液中再加入NaOH溶液,若不再出现红色,应为原因②,若再出现红色,应为原因①
14.位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是自然界中含量最高的金属。根据你的推断完成下列问题:
(1)B元素的名称为_____________,E的元素符号为_____________。
(2)由A、B两种元素形成的原子个数比为1∶1的化合物的电子式__________________。
(3)写出由上述元素形成的具有漂白作用的四种物质的化学式_________________________、___________________、_______________________、____________________。
(4)用电子式表示C与D形成化合物的过程_______________________________________。
(5)写出E的最高价氧化物与强碱反应的离子方程式_______________________________。
答案:(1)氧 Al
(2) 
(3)SO2 O3 H2O2 Na2O2
(4)Na·+ +·Na→Na+[
+·Na→Na+[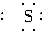 ]2-Na+
]2-Na+
(5)Al2O3+2OH-====2 +H2O
+H2O
13.如图,在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
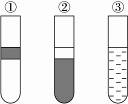
A.①加入的是CCl4,②加入苯,③加酒精
B.①加入的是酒精,②加入CCl4,③加苯
C.①加入的是苯,②加入CCl4,③加酒精
D.①加入的是苯,②加酒精,③加CCl4
解析:溴水在四氯化碳、苯、酒精中的溶解度远远大于在水中的溶解度。酒精与水互溶。四氯化碳不溶于水、比水的密度大,它将溴水萃取于下层。苯不溶于水,比水的密度小,它将溴水萃取于上层。
答案:C
12.设某元素原子核内的质子数为m,中子数为n,则下列论断正确的是( )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳12原子质量为W g,此原子的质量为(m+n)W g
D.该原子核内中子的总质量小于质子的总质量
解析:B选项m+n为质量数,是同位素相对原子质量的近似值,不是元素的相对原子质量。
C选项此原子的质量近似等于(m+n)×W/12 g。
D选项不一定,若为 ,则中子质量小于质子质量,若为
,则中子质量小于质子质量,若为 ,则中子质量大于质子质量。
,则中子质量大于质子质量。
答案:A
11.钾的金属活动性比钠强,根本原因是( )
A.钾的密度比钠的小
B.钾原子的电子层比钠原子多一层
C.钾与水反应比钠与水反应更剧烈
D.加热时,钾比钠更易汽化
解析:金属活动性属于化学性质,化学性质决定于原子的结构,K原子半径大,易失电子。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com