
题目列表(包括答案和解析)
8.短周期元素X、Y、Z在周期表中的位置关系如图所示:

(1)X元素单质的化学式是___________________,若X核内中子数与质子数相等,则X单质的摩尔质量是__________________。
(2)Y单质的电子式是____________,Z与钙形成的化合物的电子式是_____________。
解析:(1)因为X、Y、Z都是前三周期元素,则X只能为原子序数为2的稀有气体氦,Y为氟元素,Z为硫元素。
(2)根据磷元素在周期表中的位置(从左到右排列),Si、P、S原子半径依次减小,则磷原子半径介于硅原子和硫原子之间,可能范围是1.02-1.17。
答案:(1)①He 4 g·mol-1
②:
30分钟训练(巩固类训练,可用于课后)
7.下列性质可以证明某化合物一定存在离子键的是( )
A.可溶于水 B.具有较高熔点
C.水溶液能导电 D.熔融状态下能导电
解析:只有离子化合物在熔融状态下能导电;溶解性、熔沸点高低、水溶液的导电性均不能证明某化合物是离子化合物。如氯化氢能溶于水,水溶液也能导电,但它是共价化合物;SiO2具有较高的熔点,也是共价化合物。所以A、B、C项均不正确。
答案:D
6.氢化钠(NaH)是一种白色的离子化合物,其中钠显+1价,NaH与水反应放出氢气。下列叙述正确的是( )
A.NaH在水中显酸性
B.NaH中氢离子的电子层排布与氦原子相同
C.NaH中氢离子半径比锂离子半径大
D.NaH中氢离子被还原为氢气
解析:解题时应注意新信息与旧知识的联系。根据题干信息,NaH是离子化合物,钠显+1价,由此得出其中H为H-;抓住H+与H-结构不同,则性质不同,逐一筛选。因NaH与水反应放出氢气,根据氧化还原反应的规律可推知,另一产物必为氢氧化钠,溶于水显碱性,则A项错误。H-是H得到一个电子形成的,则核外有两个电子,与氦原子电子层结构相同,B项正确。H-与Li+两种离子具有相同的电子层结构,按其规律判断核电荷数大的半径小,则C项正确。H-→H2化合价升高,被氧化,D项错误。
答案:BC
5.下列叙述正确的是( )
A.两种元素组成的共价化合物中的化学键都是极性键
B.两种不同的非金属元素原子间形成的化学键都是极性键
C.含有非极性键的化合物一定是共价化合物
D.气态单质分子中一定含有非极性键
解析:A项不正确,如H2O2分子中既有极性键,又有非极性键。B项正确,两种不同的非金属原子吸引共用电子对的能力肯定不相同。C项不正确,如离子化合物Na2O2中含有非极性键。D项不正确,如稀有气体的单质为单原子分子,不存在化学键。
答案:B
4.下列表达方式中错误的是( )
A.氯化氢分子的电子式:H+[∶Cl∶]-
B.S2-的结构示意图: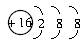
C.O-18的原子符号:
D.CO2分子的结构式:O==C==O
解析:氯化氢是共价化合物,电子式中无方括号和电荷数。
答案:A
3.下列电子式书写正确的是( )
A. B.
B.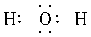
C. 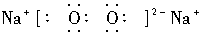 D.
D.
解析:A项中氯离子的电子式书写错误;D项中氯离子应该用方括号括起来,钙离子不括。
答案:BC
2.下列变化中化学键不被破坏的是( )
A.加热NH4Cl B.干冰汽化
C.HCl溶于水 D.NaOH固体熔化
解析:发生化学变化,则化学键一定被破坏。NH4Cl加热分解,导致化学键被破坏;氯化氢溶于水,电离出H+和Cl-,共价键被破坏;NaOH固体熔化,离子键被破坏;只有干冰汽化属于物理变化,化学键未被破坏。
答案:B
1.下列物质中,既含有离子键,又含有非极性键的是( )
A.NaOH B.Na2O2 C.CaCl2 D.H2O2
解析:CaCl2只含有离子键;H2O2只含有共价键;NaOH中含有离子键和极性键;Na2O2中含有离子键和非极性键。
答案:B
4.下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,只含有共价键的物质是_________________,只含有离子键的物质是___________,既含有离子键,又含有共价键的物质是____________。
解析:N2、H2O中只含有共价键;CaCl2、NaF中只含有离子键;Na2O2、KOH中既含有离子键,又含有共价键。
答案:N2、H2O CaCl2、NaF Na2O2、KOH
10分钟训练(强化类训练,可用于课中)
3.下列分子含有的电子数目与HF相同,且只有两个极性共价键的是( )
A.CO2 B.NH3 C.H2O D.CH4
解析:HF分子含有10个电子,CO2分子含有22个电子,NH3、H2O、CH4分子中虽然都含有10个电子,但只有水分子含有两个极性共价键。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com