
题目列表(包括答案和解析)
5.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图所示。其中t1-t2速率变化的主要原因是________________________________________;t2-t3速率变化的主要原因是________________________________________。

解析:Mg与HCl溶液的反应是放热反应,该反应中并存两个影响化学反应速率的外因:一是反应放出的热能使反应体系温度升高,化学反应速率增大;二是反应使HCl物质的量浓度减小,化学反应速率减小。由图像可知,在t1-t2的时间内温度变化是影响化学反应速率的主要外因,在t2-t3的时间内,HCl物质的量浓度的变化是影响化学反应速率的主要外因。
答案:反应是放热反应,温度升高使化学反应速率提高 HCl物质的量浓度变小使化学反应速率降低
10分钟训练(强化类训练,可用于课中)
4.下列反应能够瞬间完成的是( )
A.硝酸与铜反应 B.HNO3(aq)与NaOH(aq)的反应
C.光照H2与O2的混合物 D.铜绿的生成
解析:溶液中发生的离子反应,能够瞬间完成。HNO3与Cu的反应虽然剧烈,但接触不完全,也不能瞬间完成。光照H2与O2的混合物不反应,铜绿的生成是缓慢锈蚀的结果。
答案:B
3.下列化学反应需要加快化学反应速率的是( )
A.钢铁的腐蚀 B.食物腐烂
C.工业炼钢 D.塑料老化
解析:钢铁的腐蚀、食物腐烂、塑料老化,都需要减慢化学反应速率,否则就会造成材料的损耗与浪费。工业炼钢则需要加快化学反应速率。
答案:C
2.已知反应A+3B====2C+D在某段时间以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol·L-1·min-1 B.1 mol·L-1·min-1
C.2 mol·L-1·min-1 D.3 mol·L-1·min-1
解析:根据A的变化量,求出其他物质的变化量,然后根据定义进行求解。
答案:C
1.下列说法正确的是( )
A.化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率
B.在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值
C.在同一化学反应中,其化学反应速率可以用反应物浓度的改变来表示,也可以用生成物浓度的改变来表示,其值可能相同,也可能不相同
D.化学反应速率的单位可以是g/L·s,也可以是kg/L·s。甚至可以用t/L·s等来表示
解析:本题考查学生对化学反应速率概念的认识。由其概念“单位时间内反应物浓度的减小或生成物浓度的增加”,可以看出它适合于所有的化学反应,并非专指可逆反应,故A项不正确;单位时间是正值,反应物浓度的减小或生成物浓度的增加也是正值,故其比值也必为正值,B项不正确;由化学反应速度的计算公式vB= 可以看出,其单位中不可能出现g、kg、t等质量单位,D项不正确。
可以看出,其单位中不可能出现g、kg、t等质量单位,D项不正确。
答案:C
15.A、B、C、D、E五种元素,C和D原子序数分别比E和A的原子序数大1,B和D的离子具有相同的电子层结构,B是同周期中原子半径最大的元素(除稀有气体元素外)。A元素在其最高价氧化物中含量是40%,在其氢化物中的含量是94.1%,A元素原子中质子、中子、电子数相等。18 g C的单质与足量的稀硫酸反应,在标准状况下,生成22.4 L氢气。C元素原子中有14个中子。则:
(1)A、B、C、D、E各是(填写元素符号) _________________________________________。
(2)A、B、C、D、E在周期表中的位置依次是____________________________________。
(3)A、B、C、D、E中得电子能力最强的元素是_________________,失电子能力最强的元素是____________。
(4)现行元素周期表中得电子能力最强的元素是_________________,失电子能力最强的元素是______________。
(5)随着周期表的逐步完善,用发展的观点分析,元素周期表中得失电子能力最强的元素是否会发生变化?
解析:本题是将物质结构、元素及其化合物知识以及元素的结构、位置和性质等知识结合起来对元素种类进行推断。题目中要求推断的五种元素中,对A元素提供的条件很充分,对A进行有关化学式计算是解答本题的一个突破口。另外,C元素也可通过化学方程式计算求得其相对原子质量,进而确定C元素种类。
答案:(1)S、K、Al、Cl、Mg
(2)第三周期ⅥA族、第四周期I A族、第三周期ⅢA族、第三周期ⅦA族、第三周期ⅡA族
(3)Cl K (4)F Fr
(5)随着周期表的逐步完善,将来出现新的周期之后,最左下方的元素会发生变化而最右上方的元素是不会发生变化的,即得电子能力最强的元素不会变,而失电子能力强的元素会发生变化。
14.氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用生成NH3和氢氧化钠。请完成下列问题:
(1)Na3N的电子式是____________,该化合物由____________键形成。
(2)Na3N与盐酸反应生成____________种盐。
(3)Na3N与水反应属于____________反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:Na+____________N3-(填“>”“=”或“<”)
解析:钠是活泼金属,氮是较活泼非金属,Na3N属于离子化合物。Na3N与水反应,钠离子结合氢氧根离子,氮离子结合氢离子形成氨,NH3与HCl反应生成铵盐。
答案:(1)Na+[ ]3-Na+ 离子
]3-Na+ 离子
(2)2 (3)复分解 (4)<
13.某同学在画某种元素的一种单核粒子的原子结构示意图时,忘记在圆圈内标其质子数.请你根据下面的提示作出自己的判断。
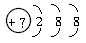
(1)该粒子是中性粒子,这种粒子的符号是__________________。
(2)该粒子的盐溶液能使溴水褪色,并出现浑浊,这种粒子的符号是________________。
(3)该粒子的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种粒子的符号是
________________。
(4)该粒子的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种粒子的符号是
________________。
解析:题设中“粒子”的核外电子排布为2、8、8,是一种稳定结构,该粒子可以是原子,也可以是阴、阳离子。如果是中性粒子即原子,核内的质子数应该等于核外的电子数,即2+8+8=18,质子数为18的元素是Ar;在溶液中能使溴水褪色并出现浑浊的物质应该是硫化物,该粒子应该是S2-;粒子得到1个电子后变为原子,则其原子的电子数应该为18+1=19,质子数应该是19,即钾原子,则这种粒子是K+,K+的氧化性很弱而钾的还原性很强,符合题目要求;粒子失去1个电子后变为原子,则其原子的电子数应该为18-1=17,质子数应该是17,即氯原子,则这种粒子是Cl-,Cl-的还原性很弱而氯原子的氧化性很强,符合题目要求。
答案:(1)Ar (2)S2- (3)K+ (4)Cl-
12.下图是某同学画的六种粒子的原子结构示意图,请你给他认真批改,指出其中的错误。
a.Li  b.K
b.K  c.Cl
c.Cl  d.Kr
d.Kr  e.S2-
e.S2-  f.Mg2+
f.Mg2+ 
解析:本题实际上可加深我们对核外电子分层排布四条规律的理解。在分析粒子的原子结构示意图正误时,这四条规律必须同时满足。原子结构示意图除可以表示原子的结构外,还可以表示阴、阳离子的结构。需要注意的是,表示阴、阳离子的结构时,核内的质子数与核外电子数是存在差别的。
答案:(1)根据电子总是尽量先排布在能量较低的电子层,应该先排满第一层再排第二层,第一层最多可以容纳2个电子,剩下1个排在第二层,所以a是错误的。
(2)第三层最多可以容纳18个电子,但是在此结构中,第三层同时是最外层,最外层容纳的电子数不能超过8个,所以K原子的核外电子排布随电子层数的递增依次为2、8、8、1,b也是错误的。
(3)第二层最多容纳8个电子,所以c错。
(4)第三层最多容纳18个电子,所以d错。(5)S2-的核外电子数为18,所以S2-的核外电子排布应该为2、8、8,所以e错。
(6)Mg2+的核外电子数为10,但核内的质子数仍然为12而不是10,所以f错。
11.下列电子式正确的是( )
A.  B.
B.
C.  D.
D.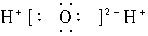
解析:
A项Na2S的电子式应为Na+[ ]2-Na+;C.NH3的电子式应为:
]2-Na+;C.NH3的电子式应为: ;D项H2O的电子式应为
;D项H2O的电子式应为 。
。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com