
题目列表(包括答案和解析)
4.演示铁在纯氧中燃烧实验时,将铁丝绕成螺旋状,其主要目的是( )
A.提高铁丝利用率 B.增大反应的接触面
C.提高反应的温度 D.使瓶底氧气充分利用
解析:将铁丝绕成螺旋状能增大接触面。
答案:B
3.硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 2SO3的说法不正确的是( )
2SO3的说法不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
解析:对于可逆反应来说,在一定条件下反应物不可能全部转化为产物,反应只能进行到一定程度即达到平衡时为一定条件下的最大程度。在达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,最终正、逆反应速率相等。即达到平衡。此时,反应物和生成物的浓度都不再随时间的延长而发生变化,但反应并没有停止,正、逆反应都依然在进行着。
答案:B
2.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A-D四个实验,你认为结论不正确的是( )
A.将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
B.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
解析:影响化学反应速率的因素很多,外界条件除浓度、压强、温度、催化剂等主要因素外,还有光、固体颗粒大小、超声波等,但A项中镁和铝由于活泼性不同,决定了镁和盐酸比铝和盐酸反应要快得多。
答案:A
1.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g(A>B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
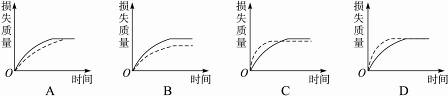
解析:粉末状碳酸钙的表面积比块状碳酸钙的表面积大,故在相同条件下,与同浓度的盐酸反应时化学反应速率快,即单位时间内损失的CaCO3的质量大,可排除A、B项。由于A>B且粉末状CaCO3的消耗量大于块状CaCO3,故当粉末状CaCO3完全消耗时,块状CaCO3尚有剩余,此后单位时间内CaCO3的损失量又大于粉末状CaCO3。故本题答案为C项。
答案:C
6.表明金属甲的活动性比金属乙的活动性强的叙述正确的是( )
A.在氧化还原反应中,甲比乙失电子多
B.同价态阳离子,甲比乙的氧化性强
C.甲能与稀盐酸反应生成氢气而乙不能
D.将甲、乙组成原电池时,甲为负极
解析:金属的活动性与失电子多少无关,如Al、Mg与酸反应,Al失去电子比Mg多,但Al的活动性不如Mg。同价态的甲的阳离子比乙的氧化性强,其金属活动性比乙弱。
答案:CD
30分钟训练(巩固类训练,可用于课后)
5.下列事实中,不能用勒夏特列原理来解释的是( )
A.加入催化剂有利于氨氧化反应
B.在氢硫酸中加碱有利于S2-增多
C.500 ℃左右比室温更有利于合成氨反应
D.高压条件有利于合成氨反应
解析:本题考查对化学平衡移动原理概念的理解及使用范围:(1)已达平衡状态的可逆反应才能使用;(2)只改变影响平衡的一个外界条件才能使用,若有多个条件改变,则要综合分析。催化剂只改变达到平衡的时间,不影响平衡移动,且氨气的氧化反应为非可逆反应,A项错。氢硫酸中存在H2S HS-+H+平衡,加碱平衡正向移动,降低H+浓度,平衡正向移动,S2-增多,B正确。合成氨为放热反应,从平衡移动的角度考虑,应使用低温,但实际采用500 ℃左右的温度是为了提高催化剂的催化效率和加快反应速率,C项错。合成氨为体积减小的反应,加压平衡正向移动提高氨的产量,D项正确。故本题不能用勒夏特列原理来解释的是A、C两项。
HS-+H+平衡,加碱平衡正向移动,降低H+浓度,平衡正向移动,S2-增多,B正确。合成氨为放热反应,从平衡移动的角度考虑,应使用低温,但实际采用500 ℃左右的温度是为了提高催化剂的催化效率和加快反应速率,C项错。合成氨为体积减小的反应,加压平衡正向移动提高氨的产量,D项正确。故本题不能用勒夏特列原理来解释的是A、C两项。
答案:AC
4.100 mL 2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
解析:A项中加入6 mol·L-1盐酸,虽然加快了反应速率,但是使产生的H2量增多。C、D项使盐酸浓度减小,速率减慢。B项中加CuCl2溶液,锌置换出铜,形成原电池,加快了反应速率,也不影响H2量。
答案:B
3.氯化银在溶液中有极微量的电离:AgCl====Ag++Cl-。下列不能说明该电离达到平衡状态的是( )
A.Ag+的浓度不再改变
B.Ag+的生成速率和Ag+、Cl-结合生成AgCl的速率相等
C.AgCl的质量不再减少
D.Ag+与Cl-的物质的量比为1∶1
解析:当一个可逆反应进行到正向反应速率和逆向反应速率相等时,反应物和生成物的浓度不再改变,就达到了“平衡状态”,故A、B、C项可说明。整个过程中,v(Ag+)=v(Cl-),不能说明。故答案选D项。
答案:D
2.在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)====2NO2(g),若N2O4的浓度由0.1 mol·L-1降到0.07 mol·L-1需要15 s,那么N2O4的浓度由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间( )
A.等于5 s B.等于10 s C.大于10 s D.小于10 s
解析:(0.1-0.01)∶15=(0.07-0.05)∶t,t=10 s,因为浓度减小,反应速率变慢,所需时间大于10 s。
答案:C
1.一定量的盐酸与过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH(s) B.H2O C.NaCl(s) D.CH3COONa
解析:本题主要考查浓度对化学反应速率的影响。铁跟盐酸反应的实质是:Fe+2H+====Fe2++H2↑,由此可知,要减缓反应速率,且不影响生成氢气的总量,就必须满足“既减小H+浓度,又不影响H+的物质的量”这个条件。
A项中NaOH与盐酸反应,H+的物质的量减小,不正确。
B项中加水,“既可减小H+浓度,又不影响H+的物质的量”,符合题意。
C项中加入NaCl固体,并没有减小H+的浓度,不符合题意。
D项中加入CH3COONa固体,能与盐酸反应生成CH3COOH这一弱电解质,使H+的浓度减小,在反应生成H2的同时又能释放出H+,故生成H2的总量不变,符合题意。
答案:BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com