
题目列表(包括答案和解析)
14.我国已开发出新型煤粉燃烧器,煤的燃烧效率可达95%以上。
(1)当今世界各国能源研究的中心议题之一,就是提高燃烧效率,_____________________。
(2)提高煤的燃烧效率通常需要考虑:①_____________________________________________;②__________________________________________。
解析:提高燃料的燃烧效率,实质上是从多方面控制燃烧反应的条件(包括环境)。它的意义在于节约能源,减少污染。
提高燃料的燃烧效率的措施归纳为两个方面:(1)尽可能使燃料充分燃烧,提高能量转化率;(2)尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
答案:(1)节约能源,减少污染
(2)①要有适当过量的空气 ②燃料与空气要有足够大的接触面
13.某学生进行右图所示的锌铜原电池的实验:
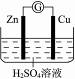
(1)从理论上讲,预期看到的现象是__________________________________________。
(2)实验过程中,观察到锌极上有少量气泡逸出,铜极上有大量气泡逸出。试解释:
________________________________________________________________________。
解析:锌铜原电池:锌比铜活泼,锌片作负极,Zn-2e-====Zn2+;铜棒作正极,H+在正极得电子,2H++2e-====H2↑。Zn片不纯,Zn与杂质构成原电池,在杂质(正极)上,产生H2。
答案:(1)Zn片溶解,Cu片上有大量气泡,电流计指针发生偏转
(2)Zn片不纯,Zn与杂质构成许多微小的原电池所致
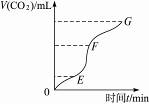
12.用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请完成下列问题:
(1)实验过程如图所示,分析判断:______________段化学反应速率最快,______________段收集的二氧化碳最多。
(2)为了减缓上述反应的化学反应速率,欲向溶液中加入下列物质,你认为可行的是______。
A.蒸馏水 B.NaCl固体
C.NaCl溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(任答两种)
解析:根据图象,可知EF段斜率最大,说明产生CO2的速率最快,即化学反应速率最快。由纵轴V(CO2)可知EF段最长,即该段收集的CO2最多。影响化学反应速率的因素很多,如温度、固体的表面积、反应物的状态、溶液的浓度、催化剂等。向溶液中加入蒸馏水、NaCl溶液可减小盐酸的浓度;加入浓盐酸增大了盐酸的浓度;加入NaCl固体对浓度无影响。故A、C项可减小反应速率。除此之外,降低温度,用块状更大的碳酸钙(减小接触面积)等可减小化学反应速率。
答案:(1)EF EF (2)AC
(3)降温 用块状更大的碳酸钙
11.合成氨反应:3H2+N2 2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)(用mol·L-1·s-1表示),则正确的关系是( )
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)(用mol·L-1·s-1表示),则正确的关系是( )
A.v(H2)=v(N2)=v(NH3) B.v(N2)=2v(NH3)
C.v(H2)=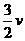 (NH3) D.v(N2)=3v(H2)
(NH3) D.v(N2)=3v(H2)
解析:根据化学反应中,用各物质所表示的速率之比等于它们在化学反应方程式中的化学计量数之比,可有如下关系:
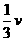 (H2)=v(N2)=
(H2)=v(N2)=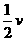 (NH3)(或v(H2)∶v(N2)∶v(NH3)=3∶1∶2)
(NH3)(或v(H2)∶v(N2)∶v(NH3)=3∶1∶2)
由此可推得以下关系式:
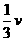 (H2)=v(N2),v(N2)=
(H2)=v(N2),v(N2)=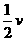 (NH3),
(NH3),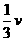 (H2)=
(H2)=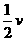 (NH3)。即正确的选项为C。
(NH3)。即正确的选项为C。
答案:C
10.锂电池是新型高能电池,它以质轻、容量大而受到重视,目前已经制成多种功能的锂电池。某种锂电池的总反应可表示为:Li+MnO2====LiMnO2。若该电池提供0.5 C电荷量,则消耗正极材料的质量约为(其他损耗忽略不计)( )
A.3.5 g B.7 g C.4.52×10-4 g D.43.5 g
解析:MnO2为正极材料,
MnO2-e-,n(MnO2)=n(e-)=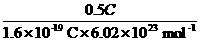 =5.2×10-6 mol,m(MnO2)=5.2×10-6
mol×87 g·mol-1=4.52×10-4 g。
=5.2×10-6 mol,m(MnO2)=5.2×10-6
mol×87 g·mol-1=4.52×10-4 g。
答案:C
9.工业上用氮气和氢气合成氨:N2+3H2 2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20 MPa-50 MPa,温度:500 ℃左右,催化剂:铁触媒。
2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20 MPa-50 MPa,温度:500 ℃左右,催化剂:铁触媒。
下列有关合成氨工业的叙述不正确的是( )
A.使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率
B.工业上选择上述条件下合成氨,可以使氮气全部转化为氨
C.上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响
D.温度升高,不利于提高反应速率
解析:使用铁触媒能等幅度地加快正、逆反应速率,虽然平衡不发生移动,但能缩短达到合成氨平衡的时间。但对于可逆反应,无论什么条件下,都不可能进行到底。通过改变影响化学平衡移动的条件(如温度、反应物的浓度、压强等因素),可以改变化学反应进行的限度。温度升高,有利于提高反应速率。
答案:B、D
8.一定温度下,某一密闭恒容的容器内可逆反应A(g)+3B(g)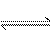 2C(g)达到平衡状态的标志是( )
2C(g)达到平衡状态的标志是( )
A.C的生成速率与C的分解速率相等
B.容器内混合气体的密度不随时间而变化
C.单位时间内生成n mol A,同时生成3n mol B
D.A、B、C的分子数之比为1∶3∶2
解析:选项A中,C的生成速率与分解速率分别是该反应中C的正、逆反应速率,由于相等,说明该反应已达到化学平衡;容器中气体的总质量不变,容器的容积不变,无论是否达到平衡,混合气体的密度不会改变,因此B中所述不是化学平衡状态;对于该可逆反应,不论是否平衡,只要生成n mol A的同时必然生成3n mol B,它们仅表明了该反应的逆反应速率,因此选项C不能判断是否达到化学平衡状态;而选项D并不能说明反应混合物中A、B、C浓度不变,也无法判断该反应是否达到化学平衡状态。
答案:A
7.高炉炼铁的主要反应是( )
2C(焦炭)+O2(空气)====2CO(放热) Fe2O3+3CO====2Fe+3CO2
炼制1 t生铁所需焦炭的实际用量,远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没有利用的CO气体。对该原因解释正确的是( )
A.CO与铁矿石接触不充分
B.增加高炉的高度可解决这个问题
C.反应难以“完全”进行彻底
D.反应中未使用催化剂
解析:很多化学反应不能按化学方程式的计量关系完全反应,故选C项。增加高炉高度与反应是否完全进行无关,B项错。A、D项只与速率有关系,所以A、D项也错误。
答案:C
6.欲使煤在煤炉中充分燃烧,下列措施可行的是( )
A.向炉内喷吹空气 B.把大块煤碾成小块
C.使用MnO2作催化剂 D.提高炉内体系的温度
解析:解答本题,要细心审题,抓住关键,在煤炉中使煤充分燃烧,不是加快燃烧速率,故C、D两项错误。尽可能使燃料充分燃烧,关键是燃料与空气充分接触,空气适当过量,故A、B两项正确。
答案:AB
5.下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KClO3,点燃时燃烧更为剧烈
B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.电解水时,加少量硫酸可使电解速率加快
解析:A项KClO3分解产生O2,增大O2浓度;C项增大固体表面积;D项增加水的导电性。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com