
题目列表(包括答案和解析)
2.在一定条件下,可与甲烷发生反应的是( )
A.氧气(光照) B.氯气(加热)
C.高锰酸钾酸性溶液(常温) D.浓硫酸(常温)
解析:常温下甲烷性质稳定,与浓硫酸、高锰酸钾酸性溶液不发生反应。常温和光照条件下,氧气不能与甲烷发生反应。加热条件下氯气能与甲烷发生反应。
答案:B
1.下列说法正确的是( )
A.有机物的水溶液都不导电 B.有机物都易燃烧
C.有机物只能从有机体中获取 D.有机物都含有碳元素
解析:CH3COOH是弱电解质,其溶液能导电,A项不正确;CCl4不能燃烧,B项错误;有些有机物是可以进行合成的,如尿素,C项不正确。
答案:D
16.目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。
(1)该电池放电时的负极材料是_________________。
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
(2)以下说法正确的是__________________。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(3)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为___________________
_____________________________________________________________________________。
(4)下图是废弃镍镉电池中的重金属渗入水体后,进入人体的一条途径:
A-B-C-D-人
生物体D中重金属浓度________________(填“大于”“等于”或“小于”)生物体A中重金属浓度,这是通过食物链_______________作用所引起的。除上述途径外,被污染水体中的重金属还可以直接通过_______________ (途径)进入人体。
(5)另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电荷量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成,电池总反应可表示为Li+MnO2====LiMnO2。
试完成下列问题:
锂电池比容量特别大的原因。
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因。
解析:根据原电池原理及生物学知识综合分析解决。
答案:(1)C (2)B
(3)在酸性土壤中,Ni(OH)2、Cd(OH)2和酸反应生成Ni2+和Cd2+
(4)大于 富集 饮水
(5)Li的摩尔质量小 2Li+2H2O====2LiOH+H2↑
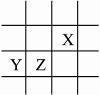
15.X、Y、Z均为短周期元素,它们在周期表中的相对位置如右图所示,已知X、Y、Z三元素的质子数之和为31,试完成下列问题:
(1)X原子的电子式为______________________。
(2)Y的最高价氧化物的电子式______________________。
(3)Z的单质与盐酸反应的化学方程式。
解析:若X质子数为n,则Y、Z质子数分别为n+8-2,n+8-1,得n+n+8-2+n+8-1=31,n=6,X为碳元素,Y为镁元素,Z为铝元素。
答案:(1) 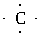
(2) 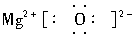 (3)2Al+6HCl====2AlCl3+3H2↑
(3)2Al+6HCl====2AlCl3+3H2↑
14.A、B、C三种元素的原子具有相同的电子层数,且B的核外电子数比A多2个,C的质子数比B多4个,1 mol A的单质与酸反应,能置换出1 g H2,这时,A转化为具有与氖原子相同的电子层结构的离子。请完成下列问题:
(1)写出A、B、C的元素符号。
(2)写出A的单质与水反应的离子方程式。
(3)写出A与C单质化合的化学方程式,指出氧化剂和还原剂。
解析:本题考查学生运用原子(或离子)结构结合化学方程式综合解题的能力。本题可以从判断单质A入手分析,因为1 mol A与酸反应置换出0.5 mol H2,所以1 mol A失去1 mol e-从而形成A+结构。A+与氖原子电子层结构相同,不难得出A是Na。其他原子的名称便迎刃而解。
答案:(1)A:Na B:Al C:Cl
(2)2Na+2H2O====2Na++2OH-+H2↑
(3)2Na+Cl2====2NaCl,其中Na是还原剂,Cl2是氧化剂
13.将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下:
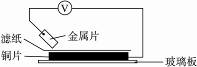
金属 电子流动方向 电压/V
A A→Cu -0.78
B Cu→B -0.15
C C→Cu +1.35
D D→Cu +0.30
已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据记录数据判断,下列有关说法正确的是( )
A.在四种金属中C的还原性最强
B.金属B能从硫酸铜溶液中置换出铜
C.A、D若形成原电池时,A为正极
D.A、B形成合金时,将该合金露置在空气中,A先被腐蚀
解析:由题意中的电子流向可知金属性强弱为A>Cu,B<Cu,C>Cu,D>Cu,由此可推断B、C项错误,D项正确。再由电压数据的最大值为+1.35,可知C的金属性最强,所以A项正确。
答案:AD
12.下列事实不能用电化学理论解释的是( )
A.镀锌铁比镀锡铁耐腐蚀
B.轮船水线以下的船壳上,镶嵌一定量的锌块
C.铝片不用特殊的方法保存
D.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后反应速率加快
解析:由于铝在空气中发生化学腐蚀生成一层氧化物薄膜,起到保护作用,所以与电化学理论无关。
答案:C
11.有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易被腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.D、C、A、B B.D、A、B、C
C.D、B、A、C D.B、A、D、C
解析:A、B形成原电池,B不易被腐蚀,则A为负极,B为正极,活泼性A>B;A、D放入HCl中,D反应剧烈,则活泼性D>A,Cu不能置换B而Cu能置换C,则活泼性B>Cu>C。所以活泼性为:D>A>B>C。
答案:B
10.下图所示能够组成原电池,并且能产生明显的电流的是( )
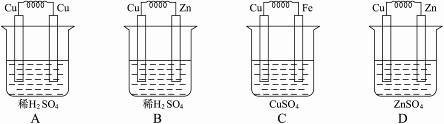
解析:首先按照构成原电池的条件,B、C、D项为原电池,但D项中的Zn与硫酸锌不反应,且溶液酸性弱,产生电流弱。
答案:B、C
9.将铁片和银片用导线连接置于同一稀盐酸溶液中,并经过一段时间后,下列叙述正确的是( )
A.负极有Cl2逸出,正极有H2逸出
B.负极附近Cl-的浓度减小
C.正极附近Cl-的浓度逐渐增大
D.溶液中Cl-的浓度基本不变
解析:Fe为负极:Fe-2e-====Fe2+;Ag为正极:2H++2e-====H2↑;Cl-的浓度基本不变。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com