
题目列表(包括答案和解析)
8.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法能实现的是( )
A. 将两种样品分别溶于硝酸,区别所产生的气体
B. 将两种样品分别溶于硝酸,区别溶液的颜色
C. 取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D. 取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
7.下列反应的离子方程式错误的是( )
A.铁跟稀硫酸反应Fe+2H+ = Fe2++H2↑
B.铜跟浓硝酸反应Cu+2N03-+4H+ = Cu2++2N02↑+2H2O
C.碳酸钙跟稀盐酸反应C032-+2H+ = CO2↑+H2O
D.铁跟氯化铁溶液反应Fe+2Fe3+ = 3Fe2+
6.室温下,在强酸性或强碱性溶液中都不能大量共存的离子组是( )
A. NH+4、Cu2+、Cl-、NO-3 B. K+、Na+、SO2-3、S2-
C .K+、Na+、AlO-2、SO2-4 D .Ba2+、Fe2+、NO-3、Br-
5.将表面已完全钝化的铝条,插入下列溶液中,能发生反应的是( )
A.稀硝酸 B.热水
C.硝酸铜 D.氢氧化钠
4.有关溶液中所含离子的检验,下列判断中正确的是( )
A.加入AgNO3溶液生成的白色沉淀不溶于稀硝酸,则原溶液中一定有Cl-存在
B.加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在
C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中
一定有NH4+存在
D.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在
3.某500mL溶液中含0.1molFe2+、0.2molFe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A.0.4mol/L B.0.6mol/L
C.0.8mol/L D.1.0mol/L
2.往100mL FeBr2溶液中缓慢通入2.24L(标况)氯气,结果溶液中有1/3溴离子被氧化成溴单质,原FeBr2溶液的物质的量浓度为( )
A.1.4mol/L B.2.8 mol/L C.1.2 mol/L D.无法计算
1.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
|
|
Na |
Cu |
Al |
Fe |
|
熔点(0C) |
97.5 |
1083 |
660 |
1535 |
|
沸点(0C) |
883 |
2595 |
2200 |
3000 |
其中不能形成合金的是( )
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
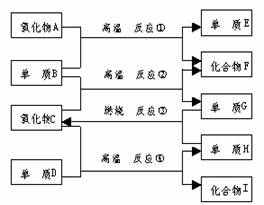
17.如右图,已知:
①单质E可作为半导体材料;②化合物F是
不能生成盐的氧化物;③化合物I能溶于水
呈酸性,它能够跟氧化物A起反应。
据此,请填空:
⑴化合物F是 。
⑵化合物I 是 。
⑶反应③的化学方程式是
⑷反应④的化学方程式是
16.把河沙(主要成分是SiO2)跟镁粉按一定质量比(质量比约大于15:24)混合均匀,装入试管中加热大约1分钟后发生剧烈反应,生成一种白色固体化合物和一种硅化物。待生成的混合物冷却后放入或有稀硫酸的烧杯中,立即产生气泡并伴有爆鸣声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下的化学方程式 ,该反应是 (填“放热”或“吸热”);
(2)生成的混合物放入稀硫酸中,产生的气体是(填分子式) ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com